光免疫療法が目指すがん治療の未来―「がんで死なない治療」への挑戦

2019.8 取材・文:がん+編集部
抗体に光感受性物質を付加した薬剤を静脈注射した後に、病変に非熱性赤色光を照射することで、がん細胞を消滅させる「光免疫療法」が、新たながんの治療法として注目されています。日本では、2018年4月から国立がん研究センター東病院で、頭頸部がんに対しての治験が開始されました。また、2019年の米国臨床腫瘍学会で、第2a相臨床試験の結果が発表され、有効性、安全性ともに良好な結果が報告されています。光免疫療法とはどのような治療なのか、光免疫療法でがん治療はどのように変わっていくのか、この治療法の開発者である米国立がん研究所の主任研究員の小林久隆先生にお話を伺いました。
※現在、日本で承認されている光免疫療法は、使用される薬剤も対象のがん種も限られています。自由診療で行われている光免疫療法は、効果や安全性が確認されていない場合もありますので、十分にご注意ください(がん+編集部注)。
光免疫療法とは
光免疫療法ではまず、がん細胞に発現している特定のタンパク質と結合する抗体に、あらかじめ非熱性赤色光と化学反応を起こす光感受性物質を付加した薬剤を静脈注射します。この抗体が体内でがん細胞に結合するのを待ち、その後、光ファイバーを病変に到達させて非熱性赤色光を照射します。すると光感受性物質が非熱性赤色光に反応して、がん細胞が破壊されます。それは、風船がはじけて壊れるようなイメージです。がん細胞の破壊には、光感受性物質と非熱性赤色光との反応が必要なため、薬剤が結合していない、もしくは非熱性赤色光が当たらない細胞では起こりません。さらに、破壊されたがん細胞の破片が免疫細胞に対する抗原となり、残ったがん細胞に対する免疫細胞の攻撃がさらに増強するという治療効果もあります。
現在開発が進んでいる薬剤は、抗体セツキシマブに光感受性物質IRDye® 700DXを付加した薬剤になります。
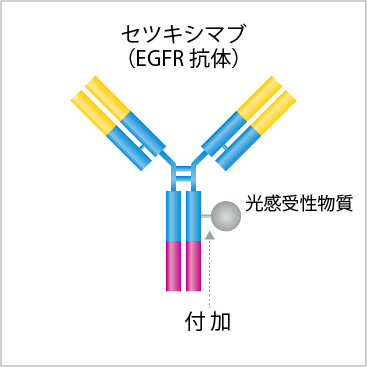
(1)光感受性物質をがん細胞と選択的に結合する抗体に付加する
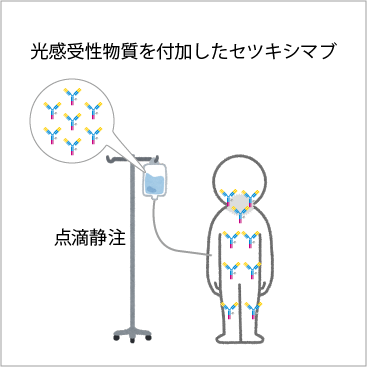
(2)光感受性物質を付加した抗体を点滴で静脈に注射する
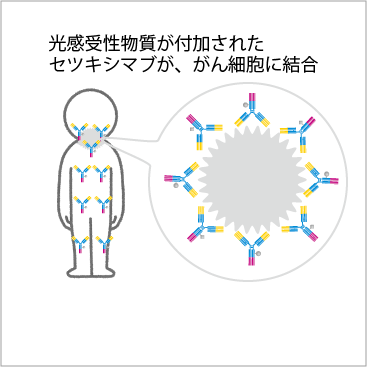
(3)光感受性物質が付加された抗体ががん細胞に結合する
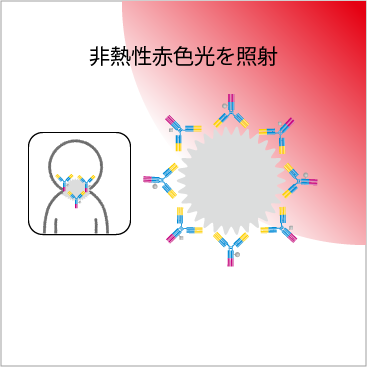
(4)がん細胞に非熱性赤色光を照射する
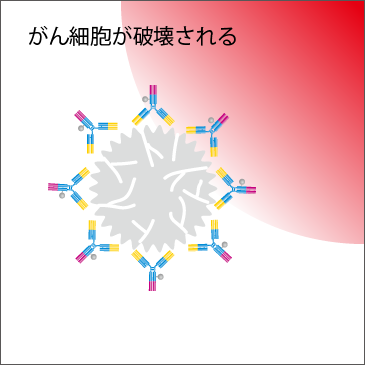
(5) 光感受性物質が非熱性赤色光と化学反応を起こしエネルギーを吸収し、急激に変化することでがん細胞を破壊する
光免疫療法のもう1つのメリット
「光を当てて破壊されたがん細胞の破片が“質の良い”抗原となり、さらにがんを攻撃する免疫細胞もダメージを受けない」というのが、がん光免疫療法のもう1つのメリットです。
これは、非臨床試験をベースとした研究ではありますが、高温の熱や凍結を用いた治療は、がん細胞のタンパク質を壊し、変性させます。光免疫療法は、熱を使ったり、凍結をしたりすることなくがん細胞を破壊します。そのため、破壊されたがん細胞の破片は、免疫細胞にとって、タンパク質が変性していない”質の良い“抗原となります。仮に、がん細胞を体の外に取り出し、ぐりぐりと物理的にすり潰したら、がん細胞のタンパク質は変性して元の状態ではなくなります。このようなタンパク質を抗原として認識させた免疫細胞を再び患者さんの体に戻す免疫療法は、以前から試されてきていますが、今のところ効果がみられたものはありません。これは、がんに対する効果的な免疫応答を得るには、“質の良い”抗原に対する免疫細胞が体内で作られる必要があることを示します。
また、手術でがん細胞を切除すると、がんに取りついて攻撃をしていた免疫細胞も一緒に取り去られます。放射線治療では、がん細胞と一緒に周辺の免疫細胞もダメージを受けます。がんを認識する能力のある免疫細胞が取り去られたり、ダメージを受けたりしてしまっては、治療後にいくらがんの攻撃に効果的な抗原が体内に残されていても、十分な免疫効果が得られません。光免疫療法は、点滴した薬剤が結合した体内のがん細胞だけを選択的に破壊します。そのため、がんの周辺に存在する免疫細胞にはダメージを与えず、生き残った免疫細胞に“質の良い”抗原を提示することが可能となり、より効果的な免疫応答が得られることになります。
光免疫療法の動物実験をしていると、がん細胞を破壊するだけでがんが治るパターンと治らないパターンがあることがあります。治るパターンでは、がん細胞を破壊すると、がんの組織に免疫細胞が入り込んでいき、がん細胞が次々と死滅して治る様子が観察されます。一方の、治らないパターンでは、免疫を強めてやる必要があります。光免疫療法でがん細胞を破壊すると、前述のように、がん細胞が壊れてできた”質の良い”抗原に対する新たなリンパ球(免疫細胞の一種)ができます。しかし、がん細胞を認識できるリンパ球がいくら体内で増えても、免疫チェックポイントが作用すると、攻撃ができません。こうした状況は、人間でも起こります。その場合には、光免疫療法に加え、ニボルマブ(製品名:オプジーボ)のような免疫チェックポイント阻害薬を併用することで、効果的な免疫効果を得られる可能性があります。逆に、免疫チェックポイント阻害薬単独で効果が得られない人は、”質の良い“抗原による効果的な免疫応答が得られていない可能性も考えられ、そのような場合には、光免疫療法の併用で、効果が得られる可能性もあります※。
※現在、免疫チェックポイント阻害薬との併用については、臨床試験など開始されていないため、作用機序をベースとした理論的な可能性になります。

がん細胞の中に免疫細胞が入り込んでいる様子
他がん種に対する光免疫療法の研究開発
私たちは、最初に光感受性物質IRDye® 700DX に非熱性赤色光を照射することで、がん細胞を破壊できることを発見しました。そこでIRDye® 700DX をがん細胞に到達させるため、がん細胞に特異的に発現しているタンパク質と選択的に結合する抗体にIRDye® 700DX を付加しました。現在臨床試験中のASP-1929は、上皮増殖因子受容体(EGFR)と選択的に結合するセツキシマブ(製品名:アービタックス)にIRDye® 700DX を付加させたものです。
まだ研究段階ですが、現在、ヒトのがん細胞を移植したマウスを使い、セツキシマブ以外の抗体でも光免疫療法の効果を検証しています。例えば、セツキシマブと同じEGFRに対する抗体薬であるパニツムマブ(製品名:ベクティビックス)、HER2に対するトラスツズマブ(製品名:ハーセプチン)、CD20に対するリツキシマブ(製品名:リツキサン)など市場に出ている製品のほか、市場に出ていない抗体などでも試しています。この研究の目的は、がんで変異している遺伝子によってできるタンパク質に対して、抗体を選べるようにすることです。今のところ、抗体の違いによらず、細胞の表面に発現しているタンパク質を認識する抗体であれば、ほぼ同じ効果が得られています。IRDye® 700DX を抗体に付加するのは、混ぜて分けるという2ステップという非常に簡単な化学技術で行えるため、さまざまな抗体に対して幅広く開発が可能です。将来的には、何らかの理由で抗体の効果がなくなった場合、別の抗体に変更するという可能性も考えています。もちろん、今、治験を行っている1つの治療法が承認されても、すぐに他の抗体も承認というわけにはいかず時間がかかるかもしれませんが、いずれ、さまざまな抗体とIRDye® 700DX とを組み合わせた治療薬ができたときには、光免疫療法は、がんに発現しているタンパク質にあわせて、抗体を選択するような形になると思います。
光免疫療法の開発にあたって
光免疫療法の開発にあたっては、IRDye® 700DX 以外にもさまざまな光吸収体を試しました。がん細胞を破壊する可能性のある化学的な仕組みをいろいろ試し、まさにトライ&エラーの繰り返しでした。最終的に、IRDye® 700DX が残りましたが、論理的にIRDye® 700DX に行きついたというより、結果IRDye® 700DX が良かったというところから、原理を確認したという形です。
開発段階では、最適な非熱性赤色光の強さや抗体の量を探るため、いろいろ試しました。非熱性赤色光は倍の強さで照射しても、到達距離が単純に倍になるわけではありません。そのため、非熱性赤色光の照射の強弱でコントロールするよりも、物理的な治療域に到達できるように非熱性赤色光を照射する光ファイバーを刺した方が効率的だとわかりました。現在臨床試験中の治療でも、体内のがんに非熱性赤色光を照射するために光ファイバーを使用しているので、がんができている部位の深さにより光が届かないなどという問題はありません。
光免疫療法が目指す最終形
がん光免疫療法の特徴として、正常細胞に非熱性赤色光が当たっても安全上大きな問題にならないという点が挙げられます。そのため、動物実験では、がん細胞があると推測される範囲に広めに照射しており、がんの部位にピンポイントで光ファイバーを刺さなければならないほどのテクニックは必要ありません。
プロフィール
小林久隆(こばやしひさたか)
1995年 米国国立衛生研究所臨床センターフェロー
2001年 米国国立がん研究所/米国国立衛生研究所シニアフェロー
2004年 米国国立がん研究所分子イメージングプログラム主任研究員

