腎細胞がんに対するアテゾリズマブの治験
治験の募集状況は、「jRCT 臨床研究等提出・公開システム![]() 」ページでご確認ください。
」ページでご確認ください。
治験名
未治療の進行腎細胞癌患者を対象としたATEZOLIZUMAB(抗PD-L1抗体)とベバシズマブの併用をスニチニブと比較する第III相非盲検ランダム化試験
治験概要
過去に補助療法または転移後の治療として、全身療法を受けたことがない手術不能、局所進行または転移性腎細胞がん患者さんを対象に、抗PD-L1抗体のATEZOLIZUMAB(アテゾリズマブ)とベバシズマブの安全性、有効性をスニチニブと比較して評価する非盲検ランダム化試験です。
疾患解説腎細胞がん
腎臓がんは、腎臓の腎実質と呼ばれる細胞ががん化した悪性腫瘍です。腎癌研究会の2002年の調査によると、人口10万人に対して男性8.2人、女性3.7人と男性に多く、年々増加傾向です。50歳代から増え始め、70歳代まで高齢になるほど罹患数は多くなります。
腎臓がんの発生原因は、喫煙と肥満といわれており、腎臓がんの予防では、禁煙と肥満にならないようなバランスのいい食事や運動が効果的だとの日本人を対象とした研究報告もあります。
腎臓がんは、あまり自覚症状がなく、約70%の人が症状のない段階で発見されています。自覚症状として多く見られるのが、血尿、背中や腰の痛み、腹部のしこり、足のむくみ、食欲不振、体重減少、吐き気、便秘、腹痛などさまざまです。
腎臓がんは、がんの組織の違いでいくつかのタイプがあり、混在していることもあります。最も多くみられる組織型は「淡明細胞型腎細胞がん」で、全体の約70~85%を占めます。そのほかに、多房嚢胞性腎細胞がん、乳頭状腎細胞がん、嫌色素性腎細胞がん、紡錘細胞がん、集合管がんなどがあります。 腎臓がんの組織型は、治療選択の判断材料の1つで、組織型の違いによって病気の進行や予後が異なります。 淡明細胞型腎細胞がんは、乳頭状腎細胞がんや嫌色素性腎細胞がんに比べて有意に予後不良といわれています。淡明細胞型腎細胞がんの腫瘍内で広範な壊死がある場合は有意に予後不良であるという報告もあります。
腎臓がん進行度
| T1a | 腎細胞がんの直径が4cm以下で腎臓にとどまる |
| T1b | 腎細胞がんの直径が4cmを超え、7cm以下で腎臓にとどまる |
| T2a | 腎細胞がんの直径が7cmを超え、10cm以下で腎臓にとどまる |
| T2b | 腎細胞がんの直径が10cmを超えて腎臓にとどまる |
| T3a | 腎細胞がんが腎静脈または周囲の脂肪組織に及ぶがゲロタ筋膜※を超えない |
| T3b | 腎細胞がんが横隔膜より下の大静脈内に広がっている |
| T3c | 腎細胞がんが横隔膜より上の大静脈内に広がる、または大静脈壁まで及ぶ |
| T4 | 腎細胞がんがゲロタ筋膜※を超えて広がる(同じ側の副腎まで及ぶ場合を含む) |
※ゲロタ筋膜:腎臓を覆っている一番外側の膜
出典:日本泌尿器科学会・日本病理学会・日本医学放射線学会,編:泌尿器科・病理・放射線科 腎癌取扱い規約第4版.2011年,金原出版より作成
腎臓がんの組織型分類
| 淡明細胞型腎細胞がん |
| 多房嚢胞性腎細胞がん |
| 乳頭状腎細胞がん |
| 嫌色素性腎細胞がん |
| 集合管がん |
| 腎髄質がん |
| Xp11.2転座型腎細胞がん |
| 神経芽腫随伴腎細胞がん |
| 粘液管状紡錘細胞がん |
| 紡錘細胞がん(肉腫様がん) |
| 腎細胞がん、分類不能型 |
治験薬アテゾリズマブ
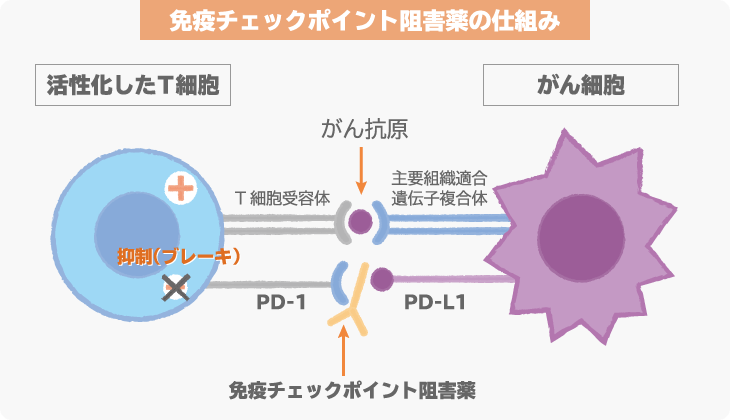
アテゾリズマブは、抗PD-L1抗体という免疫チェックポイント阻害薬の1つです。
免疫チェックポイント阻害薬は、がんに対して、免疫細胞が本来の力を発揮できるようにする薬です。最終的には、免疫の力でがんを攻撃し、治療効果を発揮します。
がん細胞の表面に発現しているPD-L1とがん細胞を攻撃する免疫細胞(T細胞)に発現しているPD-1が結合すると、免疫細胞は、がん細胞を攻撃しなくなってしまいます。この仕組みを「免疫チェックポイント機構」といい、この仕組みが働かないように開発されたのが、免疫チェックポイント阻害薬です。
主な治験参加条件
| 対象となる人 |
|---|
|
| 対象とならない人 |
|
治験情報に関する注意点
治験は、治療を兼ねた臨床試験のことです。薬の元となる物質を動物実験などで有効性や安全性を確認した上で、ヒトに対して使用しても同様に安全で治療効果が予測されるもので行われますが、治験の時点ではまだ有効性や安全性が十分に確認できているわけではありません。有効性や安全性が科学的に証明された治療が、標準治療で、新しい治療が必ずしも最良の治療ではないということを理解してください。その一方で標準治療が確立していない、または薬の耐性ができ、効果が期待できる薬がなくなった患者さんにとって治験は新しい治療選択となる可能性もあります。
治験は「ヘルシンキ宣言」に基づく倫理的原則と、日本国内では「医薬品の臨床試験の実施に関する基準(GCP) 」という厳しいルールに基づき、行われています。これにより、治験に参加される方の利益が損なわれることがないよう、安全な手続きで進められます。治験情報を探すとき、治験を受けたいと思ったときは、まず治験とはどのようなものなのかを正しく理解しましょう。
試験詳細
| 試験の名称 | 未治療の進行腎細胞癌患者を対象としたATEZOLIZUMAB(抗PD-L1抗体)とベバシズマブの併用をスニチニブと比較する第III相非盲検ランダム化試験 |
| 試験の概要 | 過去に補助療法又は転移後の治療として全身療法を受けたことがない手術不能,局所進行又は転移性腎細胞癌患者における,atezolizumab(抗programmed death ligand 1 [PD-L1] 抗体)+ベバシズマブの安全性,有効性をスニチニブと比較し評価する非盲検ランダム化試験である。 |
| 疾患名 | 腎細胞癌 |
| 試験薬剤名 | アテゾリズマブ |
| 用法・用量 | 1200 mgを3週間隔で点滴静注 |
| 対照薬剤名 | Avastin |
| 対照薬用法・用量 | 15 mg/kgを3週間隔で点滴静注 |
| 対照薬剤名 | Sutent |
| 対照薬用法・用量 | 50 mgを1日1回,4週間経口投与2週間休薬 |
| 試験のフェーズ | フェーズ3(第3相臨床試験) |
| 試験のデザイン | 多施設共同非盲検ランダム化試験 |
| 目標症例数 | 915 |
| 適格基準 |
|
| 除外基準 |
|
| 主要な評価項目 |
|
| 主要な評価方法 | RECIST version 1.1 他 |
| 副次的な評価項目 |
|
| 副次的な評価方法 | RECIST version 1.1, modified RECIST critera他 |
| 予定試験期間 | 2015年8月~2020年7月 |

