肺がんの「分子標的薬による治療」現在使用されている薬は?今後の動向は?

- 中川和彦(なかがわ・かずひこ)先生
- 近畿大学医学部 腫瘍内科教授
1957年、熊本県生まれ。1983年熊本大学医学部卒業。国立がんセンター研究所、同中央病院内科を経て、90年大阪府立羽曳野病院第二内科、97年近畿大学医学部第四内科、2002年同大医学部腫瘍内科、03年同大医学部腫瘍内科助教授(当時)、07年より現職。がんの新薬、分子標的薬治療など臨床試験に積極的に取り組み、日本における質の高い腫瘍内科の確立をめざす。
本記事は、株式会社法研が2012年3月24日に発行した「名医が語る最新・最良の治療 肺がん」より許諾を得て転載しています。
肺がんの治療に関する最新情報は、「肺がんを知る」をご参照ください。
ターゲットを絞って劇的に治療効果を上げる
がんの発生や増殖にかかわる物質を特定し、その働きを抑えてがんを治療する分子標的薬。
一般的には、これまでの抗がん薬と比べ、効果は大きく副作用は軽くなります。
分子標的薬の登場でまず遺伝子検査という流れに
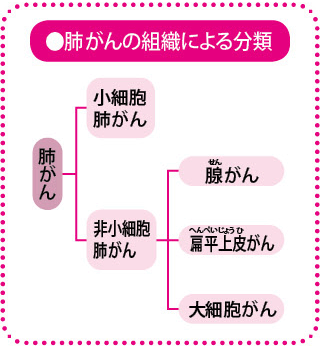
肺がんは、細胞や組織の並び方や大きさ、形(形態)などによっていくつかのタイプに分かれます。肺がん全体でいうと、10~15%が小細胞肺がん、85~90%が非小細胞肺がんになります。非小細胞肺がんは、腺(せん)がん、扁平上皮(へんぺいじょうひ)がん、大細胞がん、その他に分かれます。このように4つのタイプが知られていますが、これまで治療方針にかかわってくる条件は、小細胞肺がんか、非小細胞肺がんか、という大きなタイプ分けだけでした。ですから、これまでの化学療法では、非小細胞肺がんであれば、腺がんでも扁平上皮がんでも、治療内容に変わりはありませんでした。
ところが、最近は、腺がんであるか扁平上皮がんであるか、あるいは、がん細胞の特定の遺伝子に変異があるかないかといった、患者さんのがんがもっている性格を調べることによって、有効な薬が選択できるようになってきたのです。
この背景には、肺がんに効果的な分子標的薬が登場してきたことが大きくかかわっています。
分子標的薬というのは、がんの発生や増殖などにかかわる特定の分子(たんぱく質)をみつけ出し、その分子の働きを標的としてとらえ、抑えることでがんを治療する薬です。がんの発生のメカニズムを明らかにし、攻撃する目標をあらかじめ定めたうえで開発された薬ですから、理にかなった、効率のよい治療が行えます。ただし、誰にでも効くという薬ではなく、条件が合う患者さんには劇的に効きますが、条件が合わなければほとんど効果なし、という結果になります。実際に、患者さんの肺がんのタイプによっては、特効薬ともいえる効き目が現れ始めています。現在、肺がん全体の35~40%では、分子標的薬が中心的な治療薬として用いられている、もしくは用いられようとしている状況です。
そこで、化学療法(抗がん薬による治療)を始める際には、まず、患者さんのがんの遺伝子検査を行ってから、という手順が一般的になってきています。

がんの増殖メカニズムに作用 治療効果が高く、副作用が軽い
私の所属する近畿大学医学部腫瘍(しゅよう)内科は、分子標的薬をはじめ、肺がんの化学療法に関する臨床研究を積極的に計画・実施しています。われわれも早い時期から、多くの患者さんに分子標的薬を用いてきていますが、確かに分子標的薬は、これまでの抗がん薬よりもポテンシャル(潜在能力)が高いと実感しています。
私がここでいうポテンシャルが高いとは、腫瘍縮小効果が早く、強く現れ、長く続くということを指します。がんが生じ、増殖していくメカニズムと治療戦略が合致しているからこそ、科学的、合理的にそうした効果がもたらされます。しかも、軽い副作用でより高い効果が得られるので、リスクと恩恵のバランスが従来の治療薬よりよくなるのです。
一方、これまでの抗がん薬は、殺細胞性抗がん薬と呼ばれ、細胞全体が共通してもっている遺伝子の複製や細胞分裂を行うしくみを阻害します。がん細胞だけを狙い撃ちにすることができず、正常な細胞にまで影響を及ぼしてしまうため、さまざまな副作用を伴うことが少なくありません。使用量を増やせば、当然効果は高まりますが、それとともに副作用も重くなってしまいます。患者さんの体力なども考慮しつつ、使用量や使用期間をどのくらいにするか、常に細心の注意が求められます。
先ほども述べましたが、分子標的薬では、がん細胞に狙いを定めていますから、正常な細胞に与える影響はかなり避けることができます。
ただし、これまでとはまったく性格の違う副作用が出る可能性や、条件の合わない患者さんに対しては効果がみられない可能性もあるので、副作用を気にせず、安易に使える薬というわけではありません。現に、一時は深刻な副作用が問題になった分子標的薬もあります。むしろ、その印象が先行する人も多いかもしれません。分子標的薬は、がんの化学療法の専門医により、注意深く使用される必要があります。
薬の耐性に対し、対策や、克服のための研究を進めやすい
これまでの抗がん薬で、副作用とともに悩まされるのは、時間が経過するといずれ効かなくなる(耐性)という問題です。分子標的薬も、これまでよりは長く効果が持続するのですが、やはり、効かなくなるときがやってきます。しかし、これまでの抗がん薬と大きく違うのは、理屈にのっとった対応ができる点です。分子標的薬の効果は、そもそも理論から割り出しているものなので、効かなくなる理由を予測するのも難しいことではありません。いくつかの可能性から、今の薬にさらにこういう工夫を加えればよいとか、こういう作用をする薬を組み合わせればよいといった対策を立てることができます。
これまでの抗がん薬では、長年蓄積された経験をよりどころに薬の組み合わせや順番を決めるといった対応で乗り切るしかありません。耐性を克服できると積極的にいえるほどの決め手はないのが現状です。しかし、分子標的薬の場合、理論的な根拠に基づいて一定の方向が示されますので、薬剤の改良など、一朝一夕には実現できない対策も含まれますが、確実に克服に向けて研究を進めることができます。
分子標的薬は、われわれが、ことあるごとに患者さんや学生に対して口にしてきた「がんは遺伝子の病気である」ということを実感させられた薬ともいえます。遺伝子におこっている不ぐあいを調整すれば、がんは制御できるということが、これらの薬によって証明されたのです。
| 分子標的薬 | 従来の抗がん薬 | ||
| 作用 | がんの浸潤(しんじゅん)、増殖、転移にかかわる分子(たんぱく質)を標的にして、がんの増殖や進展を抑える | 増殖が活発な細胞を攻撃するので、がん細胞と同時に、正常細胞にも影響を及ぼす | |
| がん細胞だけを狙う能力 | 高い | 低い | |
| 長期使用 | 比較的効果が持続するので、長期に使用できる。従来の抗がん薬より、耐性ができたあとの選択肢がある | ある程度の期間がたつと、耐性ができる。長期に使用できない | |
| 副作用 | 特徴的なものが出る | 重い場合が多い | |
| 骨髄への影響 | ほとんどない | 高頻度 | |
| 心臓、腎臓への影響、脱毛、口内炎 | 薬による | 高頻度 | |
| 吐き気、嘔吐 | 出る場合もある | 高頻度 | |
現在使用されている薬は?
02年、最初の分子標的薬を世界に先駆け承認。
肺がんの治療に、現在3つの分子標的薬が用いられ一定の条件を満たす患者さんには、大きな治療効果が期待できます。
最初に認可された分子標的薬はイレッサ

では、肺がんの治療で使用される分子標的薬について少し具体的に解説してみましょう。
日本で初めて、肺がんの治療薬として認可された分子標的薬は、ゲフィチニブです。商品名であるイレッサというほうが、一般にはなじみが深いかもしれません。
われわれの施設は、ゲフィチニブの開発段階から、中心的な施設として臨床試験に参加しています。臨床試験は1998年に開始され、アメリカ、ヨーロッパでも同時に行われましたが、2002年に、ゲフィチニブは世界に先駆け、日本で初めて承認されました。
当初は、非小細胞肺がんのうち、手術や放射線治療ができない患者さんで、かつなんらかの抗がん薬治療を受けたあとに再発した患者さんが対象でした。これまで経験したことのないような効果に加え、1日1錠飲むだけという手軽さも相まって、またたく間にゲフィチニブは「夢の薬」としてもてはやされました。
ところが、その後、間質性肺炎という深刻な副作用で亡くなる患者さんが現れ始め、今度は、一転して逆風にさらされるという状況になってしまったのです。しばらく社会を騒がせた問題なので、ゲフィチニブに対しては、本来の姿を理解することなく、マイナスイメージをもち続けている一般の人も少なくないかもしれません。
深刻な副作用を防ぐには薬を正しく知ることが大切
われわれ専門医は、副作用がまったくない「夢の薬」として吹聴したり、安易な使用を助長したりしたつもりはありませんが、決して少なくない数の患者さんが亡くなるに至ったことは残念でなりません。
リスクも含めて、薬を正しく知ってもらうことは医療に身を置く者の責任でもあり、その後、徹底した調査を行い、事態の解明に努めました。その結果、間質性肺炎をおこしやすい条件や確率などが明らかになり(肺線維(せんい)症を合併、喫煙者、肺機能や全身状態が悪いなど)、使用にあたっては、医師の十分な管理のもと、注意を怠らないようにとの提言を行っています。
きちんとした理解に基づき、適切な使用法を守る限り、ゲフィチニブの効果は、ある一定の患者さんにとっては福音ともいうべきものです。
●肺がんでは、常に注意が必要な間質性肺炎
間質性肺炎とは、一般の肺炎とは違い、肺胞(はいほう)そのものではなく、肺胞や肺胞の壁を取り囲んで、肺を支えている組織(間質)に炎症がおこるものです。炎症が悪化していくと、肺胞の壁が厚くなったり、肺胞の形が不規則になったりしていきます(線維化(せんいか)。線維化により肺全体がかたくなると、肺のふくらみが悪く、酸素をうまく取り込めなくなり、息切れや乾いたせき、さらに呼吸困難といった症状が現れます。重症化すると有効な治療法がないため、予防が重要です。
肺がんの患者さん、とくに喫煙歴の長い人では、すでに肺の線維化が進んでいる場合が多く、肺がんの治療によってさらに悪化し、深刻な肺機能の低下や重症の間質性肺炎を招く可能性が高まります。そこで、肺がんの治療を開始するにあたっては、常に注意すべき副作用とされています。
がんの増殖を促す信号が伝わるのをじゃまする
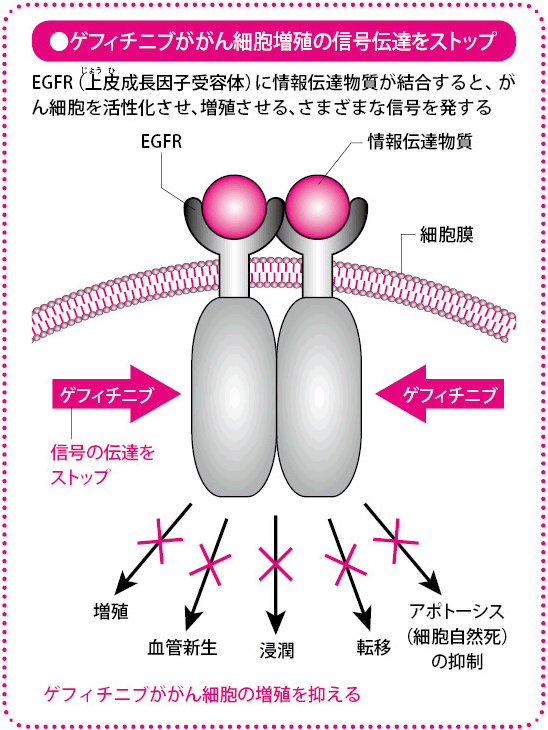
ゲフィチニブは、EGFRチロシンキナーゼ阻害薬(TKI)とも呼ばれ、その名の表すとおり、この薬の標的はEGFRです。EGFRとは、上皮成長因子受容体といい、すべての細胞がもっている分子です。この分子がたくさん現れているがん細胞は、増殖が促進されていることが以前から知られています。
EGFRは細胞膜を貫くようにして存在しています。細胞の外に出ているこの受容体の先に情報を伝える物質(情報伝達物質)が結合すると、細胞の内部に向かって「増殖しろ」と命令する信号を発します。この信号が核に伝達され、がん細胞の増殖が活発に行われるようになるのです。
簡単に説明していますが、実際には、受容体が結合する、信号を発する、信号が伝達されるといったいくつかのプロセスには、複雑な多くの化学反応が次々におこっており、多種多様な酵素をはじめとするたくさんの物質がかかわっています。その反応のどこを狙えば効率よくがん細胞の増殖を阻止できるかが、がん攻撃の戦略となるわけです。
ゲフィチニブは、信号を発する際におこる反応の1つを抑えて、信号が核に伝わるのを防ぎます。
2007年に認可されたエルロチニブ(商品名タルセバ)も同じ作用をもつ分子標的薬です。
治療効果の高い患者さんに共通する特性がある
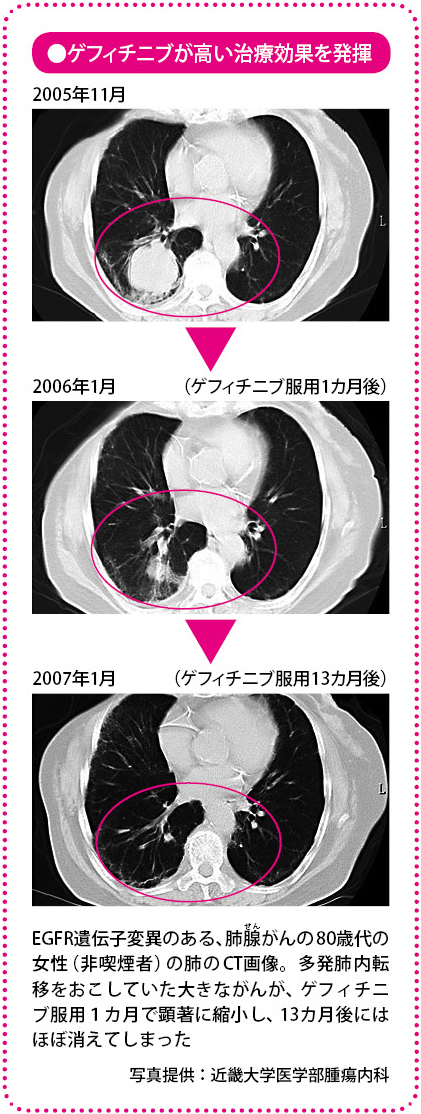
分子標的薬は、がんが個別にもっている生物学的な特性によって、効果に違いが出ることがしばしばみられます。つまり、使用する前に、患者さんのがんの特性を調べれば、その薬の効果が予測できるわけです。このような効果の有無を判断する目安となる指標をバイオマーカーといいます。当初、ゲフィチニブでは、こうしたバイオマーカーは明らかになっていませんでした。
ところが、臨床試験を進めるうちに、ゲフィチニブの効果には、ある傾向がみられることに気づきました。腺がん、アジア人、女性、非喫煙者という条件に当てはまると、非常に大きな効果が認められたのです。その共通の条件を説明できるなんらかのバイオマーカーがあるのではないか。各国の研究者がそれを解明しようと、分析を重ね、私たちもさまざまな試みを行っていました。
そこに風穴をあけたのが、アメリカの研究者です。ゲフィチニブの効果が大きかった患者さんのがん細胞には、EGFRのある部分に特定の遺伝子変異があることを発見し、報告したのです。この遺伝子変異がある肺がんに、ゲフィチニブがよく効く、つまり、EGFR遺伝子変異がバイオマーカーであるということが明らかになったわけです。
薬の有効性を比較するアジア地域での臨床試験
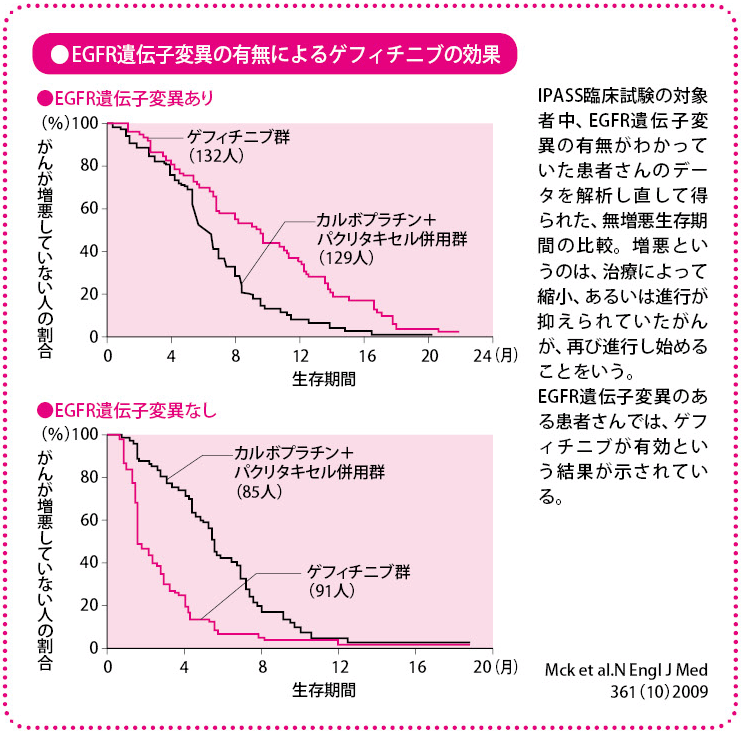
この発表から3年後、私たちは、アジア9カ国が合同で行うIPASS(IRESSA Pan-Asian Study)という臨床試験を計画していました。欧米に比べ、ゲフィチニブの効果が高い患者さんが多いアジア地域で、従来の化学療法と有効性を比較しようという目的です。もし、ゲフィチニブのほうが効果が高いという結果が得られれば、再発の場合だけでなく、最初の治療からゲフィチニブを選択できる可能性も出てきます。
この臨床試験は、ゲフィチニブの効果が比較的高いと期待される非喫煙者(軽度の喫煙者も含む)で、進行腺がんの患者さんを対象に、最初に行う治療とし、カルボプラチン(商品名パラプラチンなど)+パクリタキセル(商品名タキソールなど)の併用療法とゲフィチニブの服用による効果を比べるものでした。
その結果、治療開始後6カ月までは従来の化学療法のほうが効果的だが、それ以後はゲフィチニブのほうが有効という、興味深い成績が得られたのです。これは、通常の治療法の効果を比較する臨床試験ではあまりみることのない現象でした。
そこで、EGFR遺伝子変異の結果が判明していた対象者だけを選び出し、治療成績のデータを解析し直したところ、見事にEGFR遺伝子変異とゲフィチニブの効果の関連性が示されました。EGFR遺伝子変異のある患者さんでは、明らかにゲフィチニブが有効であり、変異のない患者さんでは、ゲフィチニブはまったく効果が認められず、従来の化学療法が有効という結果が得られたのです。
その後、最初からEGFR遺伝子変異のある患者さんを対象にした、ゲフィチニブと標準的な化学療法の比較試験が2つ、日本で行われました。その成績はどちらも、IPASSのEGFR遺伝子変異の有無による解析から得られた成績を裏づけるものでした。
がんの遺伝子検査の結果で使用する抗がん薬を決定する
こうしたIPASSや日本での臨床試験の結果は、国際的な学会でも非常にインパクトをもって受け止められ、高い評価を得ました。日本の豊富で緻密(ちみつ)なデータの蓄積とアイディアによって、ゲフィチニブという新しいタイプの肺がんの治療薬の適切な使用方法の道筋がつけられたといっても過言ではありません。
つまり、非小細胞肺がんの治療で、(1)ゲフィチニブを使うにあたっては、まず患者さんの選択が必要である、(2)そのためにはEGFR遺伝子の検査を行い、変異のあるなしを確認しなければならない、(3)その検査結果に基づき使用する抗がん薬を決定する、という流れが、国際的に専門家の間で広く同意が得られ、日本の治療ガイドラインだけでなく、欧米のガイドラインまで書きかえられることになりました。
日本では、EGFR遺伝子検査は健康保険適用として認められ、肺がんと診断された患者さんには、欠かせない検査となっています。
当初、2次治療以後の非小細胞肺がんの患者さんに使用が限られていたゲフィチニブでしたが、現在は、EGFR遺伝子変異のある患者さんに対して、初回の治療から使用できるようになりました。ただし、初回にゲフィチニブを使い、再発後に従来の化学療法を行うのと、初回に従来の化学療法を行い、再発後にゲフィチニブを用いるのとでは、どちらが有効かを明確に示すデータは今のところなく、どちらを先に使っても全生存期間に差はありません。いえることは、病気に煩わされずに過ごせる時間(再発するまでの期間)は、ゲフィチニブのほうが長いということです。
生活の質を保てる治療薬の選択を
ゲフィチニブは飲み薬(1日1錠)なので、体調の変化に注意し、異常がおこったときの連絡方法をきちんと決めておけば、治療による生活への負担を軽くできます。一方、従来の化学療法でシスプラチン(商品名ブリプラチン、ランダなど)を用いる抗がん薬治療では点滴で投与し、点滴の種類も量も多くなります。副作用の管理のため、血液検査や尿量のチェックなどもありますので、少なくとも1コース目は入院が必要になります。
こうした治療内容の違いは、患者さんの社会的な背景や考え方(年齢、体力、職業の有無や人生観など)によってとらえ方が変わってきます。進行がんの患者さんの場合、根治をめざすことは目的とはなりえないので、生活の質は非常に大切です。何を優先させるかによって、治療の選択も左右されます。このほか副作用の出かたや、今後予想される病状の変化についてよく説明し、患者さんとともに治療方針を決めるようにしています。
ゲフィチニブでもっとも注意すべき副作用は、間質性肺炎です。ときに非常に深刻な状態を招くこともあるので、使用を始めるにあたっては、患者さんに十分に説明をし、息切れや発熱などいつもと違う症状があった場合にはただちに使用を中止し、医療機関に連絡をするよう徹底します。そのほか、にきびのような湿疹(しっしん)や爪(つめ)の炎症、肝障害、下痢などの症状がみられることがあります。
遺伝子変異のない患者さんにも効果を示すエルロチニブ
エルロチニブも、ゲフィチニブと同様にEGFRチロシンキナーゼ阻害薬と呼ばれる種類の分子標的薬です。当然、EGFR遺伝子の変異のある患者さんに対して効果が高いのですが、ゲフィチニブが変異のない場合には効果がないのに対し、エルロチニブは、変異のない患者さんでも、変異のある場合には劣るものの効果があるとされています。
現在、日本では、非小細胞肺がんのうち、手術が行えない進行がんで、化学療法を行ったあとに再発をおこした患者さんに対して使用が認められています。まだ、初回治療での使用は認められていません。
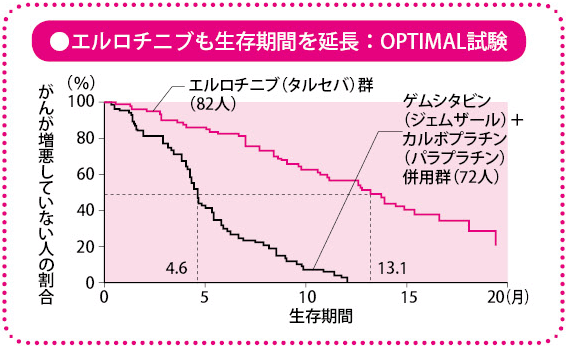
しかし、スペインがフランス・イタリアと共同で行った臨床試験(EURTAC試験)、中国が行った臨床試験(OPTIMAL試験)などの報告により、EGFR遺伝子変異のある患者さんに対して、エルロチニブを治療の最初から使用してもよいのではないか、との方向性が示されています。OPTIMAL試験では、従来の化学療法よりエルロチニブのほうが効果があり、再発までの期間を約3倍延長するという成績が得られています。
副作用の現れ方は、ゲフィチニブとほぼ同様です。従来の抗がん薬に多い脱毛や、骨髄への影響による白血球の減少などは比較的少なく、皮膚・爪の乾燥や炎症、下痢、肝機能障害、間質性肺炎などに注意が必要です。皮膚症状については、ゲフィチニブに比べ、エルロチニブのほうが現れる確率が高く、使用量とのかかわりが指摘されています。
実際の使用にあたっては、ゲフィチニブは250mg錠だけですが、エルロチニブには150mg、100mg、25mgの3種類があり、副作用の程度によっては、用量を調整しやすいということがあります(ただし、決められている使用量はゲフィチニブとエルロチニブでは違います)。

これらの分子標的薬で、肺がん治療は個別化の時代へ
これらEGFRチロシンキナーゼ阻害薬と呼ばれる分子標的薬について、当初は、腺がん、非喫煙者、アジア人、女性といった臨床的な背景から効果を予測していましたが、今では、EGFR遺伝子の変異という明らかなバイオマーカーが発見されています。その検査によって、効果が予測でき、より有効性が得られる患者さんを選んで、効率よく薬を投与できる時代になってきています。
この2剤の登場は、肺がんの治療は、誰にでも一律に行うのではなく、患者さんごとに適切な治療を選ぶという個別化の時代に入ったことを物語っているといえるでしょう。
ほかの抗がん薬との併用で効果を上げる薬もある
さて、日本で使用されているもう1つの分子標的薬は、ベバシズマブ(商品名アバスチン)です。この薬は、EGFRチロシンキナーゼ阻害薬とは、また種類の違う分子標的薬で、点滴で投与します。
ベバシズマブは、2007年に大腸がんに用いる薬として認可され、09年に肺がんでの使用が認められました。残念なことに、ベバシズマブに対しては、まだバイオマーカーがみつかっておらず、より大きな効果が期待される患者さんを選ぶ手段がありません。
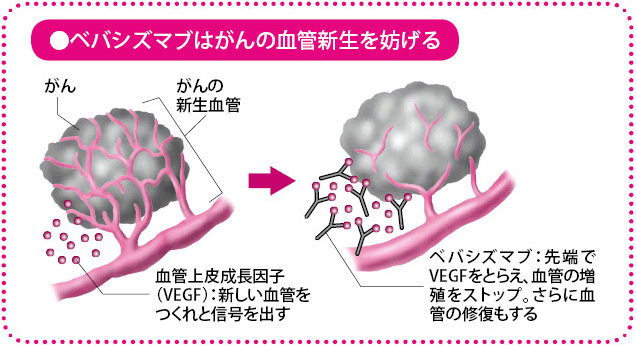
この薬は、血管新生阻害薬とも呼ばれます。がん細胞は増殖していくのに必要な栄養や酸素を確保するために、どんどん新しい血管を増やしていくことが知られています。このとき、「血管を増やせ」という命令を伝達するのが、血管上皮成長因子(VEGF)です。
ベバシズマブはこのVEGFの働きを抑えます。新しい血管がつくられるのを妨げると同時に、新生血管によって構造が変形してしまった血管の修復も行い、抗がん薬が効率よく運ばれるのを助けます。つまり、ベバシズマブは、ほかの抗がん薬と併用することで、その効果を補強するという働きをもっているのです。
副作用に配慮して慎重に使用する
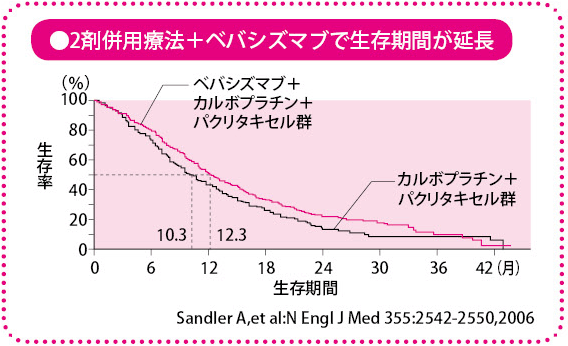
日本で行われた臨床試験では、カルボプラチン+パクリタキセルと、それにベバシズマブを加えた場合を比較していますが、カルボプラチン+パクリタキセルでは30%だった奏効率(がんが消滅、縮小した人の割合)が、ベバシズマブを加えたほうでは、60%以上に上がっているという結果が報告されています。アメリカで行われた臨床試験では、生存期間の延長も示されました。ただし、ヨーロッパでは、生存期間は延長しないという試験結果もあり、まだ結論は出ていません。
ベバシズマブの副作用としては、出血、血圧の上昇、血栓症、消化管穿孔(せんこう)などがあります。まれですが、重症化する場合もありますので、使用する際には、慎重に行う必要があります。とくに、喀血(かっけつ)の経験のある患者さんでは、深刻な事態を招く可能性が高くなるので、使用にあたっては、必ず確認します。
臨床試験では、扁平上皮がんの患者さんに喀血が多くみられたことから、扁平上皮がんの患者さんには使用しません。
今後の動向は?
特定のタイプのがんによく効く新しい薬が認可される予定です。
的を絞った新薬の研究開発も積極的に行われがん治療薬の専門医、腫瘍内科医の役割が重要に。
患者さんごとに、適した治療法を選べる時代へ

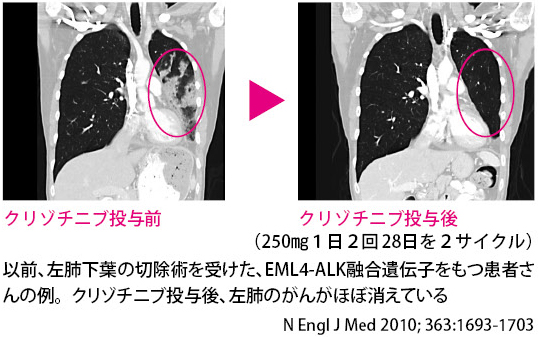
次の分子標的薬として、もっとも期待されているのがクリゾチニブという薬です。これは、ALK阻害薬といい、EML4‐ALK融合遺伝子という変異した遺伝子をもつ患者さんを対象に用います。その条件に合えば、劇的な効果がもたらされることが、国内外の臨床試験で示されています。
EML4‐ALK融合遺伝子をもつ患者さんは、比較的若い、喫煙歴のない患者さんが多く、腺がんの約5%に存在するといわれます。そうした患者さんたちのためにも、非常に大きな期待とともに承認が待たれるところです。
そのほか、かなり現実味を帯びてきているのは、ゲフィチニブの耐性の克服をめざすアファチニブです。現在、大腸がんに使用されているセツキシマブとの分子標的薬どうしの併用が注目されています。また、分子標的薬の効果を予測するバイオマーカーの研究が進むことで、従来の化学療法の効果の予測ができそうなデータもみられ始め、どの患者さんにどの治療法がより効果的であるかが、徐々にわかるようになってきています。
今後はますます、豊富な臨床研究が要求される時代であり、肺がんの治療においては、化学療法の専門家である腫瘍内科医の役割が、これまで以上に重要になってきます。
決め手が少ないといわれる肺がんの治療ですが、バイオマーカーの発見と一定の結果が得られる正確な検査技術の定着で、患者さんごとにより適切な治療法(薬の組み合わせ)を選ぶ。そんな質の高い治療体系の構築が緒についたといえる時代になってきたのではないでしょうか。
期待の分子標的薬が承認へ
クリゾチニブは、今春(2012年3月以降)に、承認が待たれる期待の分子標的薬です。別名ALK阻害薬と呼ばれ、ALK遺伝子がつくり出す酵素を標的に、その働きを阻害し、肺がんの増殖を止めようとする薬です。
がん細胞からALK酵素がたくさ出ているタイプの肺がんには、ある遺伝子変異がおこっています。それを世界で初めて発見したのは、日本の研究者・間野博行(まのひろゆき)自治医科大学教授です。間野教授が発見した遺伝子変異は、「EML4‐ALK」融合遺伝子という形で、EML4とAL Kという2つの遺伝子が途中でちぎれてしまい、それがくっついた(融合した)遺伝子です。
ALKがつくり出す酵素は、細胞の増殖にかかわりますが、EML4‐ALKという融合した形になると、正常なら必要なときにしか活性化しない酵素の働きが、常にスイッチオンの状態になり、細胞が増殖し続けることになってしまうのです。
これを抑えるのがクリゾチニブで、すでに血液がんの一種である悪性リンパ腫でよく似た働きをする分子標的薬が用いられていたため、この開発は非常に効率よく進みました。
アメリカではいち早く、2011年8月に局所進行がん、転移性がんに対しての承認が得られています。韓国や、少し遅れて日本でも臨床試験が進められていますが、すでに末期でベッドから起きられない患者さんがクリゾチニブ投与後には通常の生活ができるまでに回復するなど、がんに対する非常に高い効果が報告され、専門家を驚かせています。
残念ながら、耐性がみられるとの報告もありますが、すでに、そのメカニズムを想定し、克服する薬の研究も進んでいます。
クリゾチニブは、EML4‐AL Kという融合遺伝子のある患者さんにしか効果がないので、事前にそれを調べる検査が欠かせません。費用的にも、効率的にも、最善の体制づくりが待たれるところです。