がんゲノム医療の治療
がんゲノム医療の現状と遺伝子別の治療などを解説します。
がんゲノム医療とは
がん細胞がもつ遺伝子の変化が明らかになっていたことで、遺伝子をターゲットにした治療薬が開発されるようになりました。さらに、異なる臓器に発生したがんでも、同じ遺伝子の変化があれば、同じ治療薬の効果が期待できることから、臓器にかかわらず(臓器横断的に)、がんゲノム情報を基にした治療が行われるようになってきています。
米国国立がん研究所によると、臓器横断的治療(tumor-agonistic therapy)は「がんの種類や発生部位に関係なく、がんの遺伝的および分子的特徴に基づいて、薬剤等を用いて行うがん治療法の一種」と説明されています。
がん遺伝子パネル検査から得られた情報を基に、診断や治療を行う医療を「がんゲノム医療」といいます。しかし、がん遺伝子パネル検査で、がんの原因となる遺伝子の変化が見つからないこともあります。また、そうした変化が見つかっても、その遺伝子をターゲットにした治療薬がない場合もあります。
ここでは、現在がんゲノム医療の標的とされている遺伝子「dMMR」「NTRK」「TMB-H」「BRAF」「HER2」「FGFR」「RAS」「BRCA1/2」「ALK」に対する治療を紹介します。
dMMR
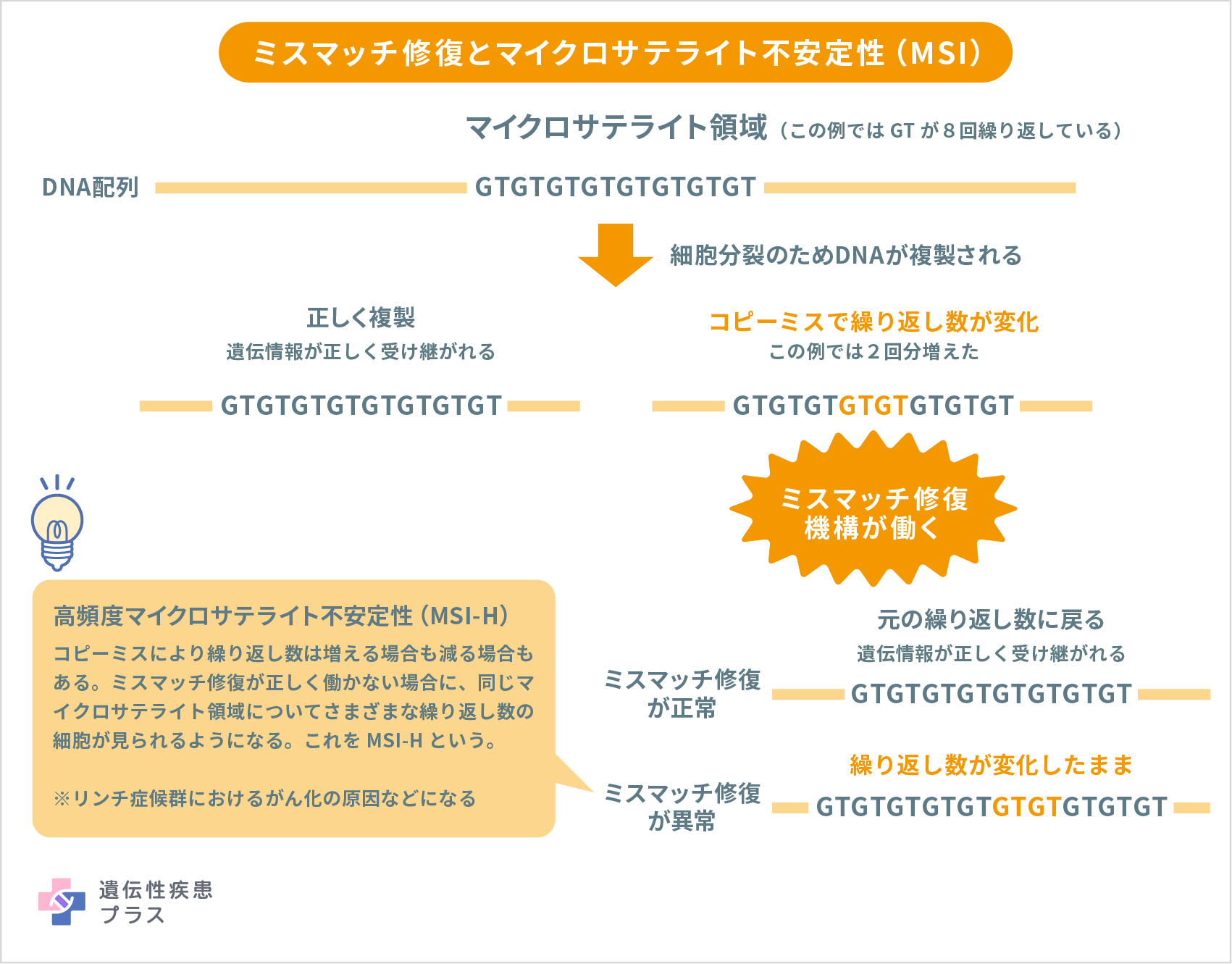
細胞が分裂し増殖する際にDNAがコピーされますが、コピーミスが起こることがあります。しかし、DNAには、こうしたコピーミスを修復する機能があり、この機能をミスマッチ・リペア(mismatch repair:MMR)といいます。また、MMR機能が低下している状態をMMR deficient(dMMR)といい、機能が保たれている状態をMMR proficient(pMMR)といいます。
ゲノムには数個の塩基から成る短い塩基配列が何度も繰り返す部分(マイクロサテライト)があり、MMR機能が低下するとその反復回数に変化が生じ、不安定な状態になることがあります。こうした状態をマイクロサテライト不安定性(microsatellite instability:MSI)といい、高頻度に認められる場合をMSI-High(MSI-H)といいます。マイクロサテライトの異常が、がんの発生に直接つながるわけではありませんが、MSI-Hが認められる組織は、がんが発生しやすい状態と考えられています。
2018年12月~2019年11月に国内で実施された「切除不能・再発固形がんのMSI検査(2万6,469人)」の解析結果によると、MSI-Hの頻度は3.72%でした。100人以上でMSI-Hが認められたがん種は、頻度の高い順に「子宮内膜がん」「小腸がん」「胃がん」「十二指腸がん」「大腸がん」でした。また、リンチ症候群の患者さんでもMSI-Hが認められます。
リンチ症候群は、遺伝的にがんになりやすい体質の1つで、特に発症しやすいがんは「大腸がん」と「子宮内膜がん」です。同時に複数のがんにかかったり、1つのがんが治った後に、他のがんや同じがんに再度かかったりすることもありますが、リンチ症候群であれば必ずがんを発症するというわけではなく、生涯発症しない人もいます。
※リンチ症候群に関しては、QLife遺伝性疾患プラスの記事「リンチ症候群」もご参照ください。
がん種別MSI-Hの頻度
| 100例以上のがん種 | 頻度 |
| 子宮内膜がん | 16.9% |
| 小腸がん | 8.6% |
| 胃がん | 6.7% |
| 十二指腸がん | 5.6% |
| 大腸がん | 3.8% |
| 神経内分泌がん | 3.4% |
| 前立腺がん | 3.1% |
| 肉腫 | 2.3% |
| 卵巣がん | 2.2% |
| 胆道がん | 2.2% |
| 子宮頸がん | 1.8% |
| 胆のうがん | 1.5% |
| 肝細胞がん | 1.1% |
| 食道がん | 1.1% |
| 乳がん | 0.9% |
| 子宮肉腫 | 0.9% |
| 膵臓がん | 0.8% |
| 胸腺がん | 0.7% |
| 小細胞肺がん | 0.3% |
| 100例未満のがん種 | 頻度 |
| 上部尿路がん | 16.7% |
| 副腎がん | 11.5% |
| 精巣がん | 9.1% |
| 尿膜管がん | 5.0% |
| 虫垂がん | 4.9% |
| 脳腫瘍 | 3.9% |
| 腹膜がん | 3.6% |
| 皮膚がん | 2.7% |
| 膵神経内分泌腫瘍 | 2.3% |
| 十二指腸乳頭部がん | 1.9% |
| 非小細胞肺がん | 1.7% |
出典:成人・小児進行固形がんにおける臓器横断的ゲノム診療のガイドライン第3版2022年2月.図2-1より作成
dMMR検査
dMMRを判定するための検査には、「MSI検査」「MMRタンパク質免疫染色検査」「NGS(次世代シークエンサー)検査」の3つがあります。
MSI検査
MSI検査は,正常組織とがん細胞の「マイクロサテライト」を調べ、その塩基配列の反復回数を測定・比較判定する検査です。マイクロサテライト不安定性検出キットとして「MSI検査キット(FALCO)」と「Idylla MSI Test(ニチレイバイオ)」が保険適用となっています。
| 一般名/製品名 | 使用目的 |
| マイクロサテライト不安定性検出キット MSI検査キット(FALCO) | がん組織から抽出したゲノムDNA中の高頻度マイクロサテライト不安定性(MSI-H)の検出 ペムブロリズマブの固形がん患者さんへの適応を判定するための補助 ニボルマブの結腸・直腸がん患者さんへの適応を判定するための補助 大腸がんにおけるリンチ症候群の診断の補助 大腸がんにおける化学療法の選択の補助 |
| マイクロサテライト不安定性検出キット Idylla MSI Test「ニチレイバイオ」 | がん組織から抽出したゲノムDNA中の高頻度マイクロサテライト不安定性(MSI-H)の検出 ペムブロリズマブの結腸・直腸がん患者さんへの適応を判定するための補助 ニボルマブの結腸・直腸がん患者さんへの適応を判定するための補助 大腸がんにおけるリンチ症候群の診断の補助 大腸がんにおける化学療法の選択の補助 |
MMRタンパク質免疫染色検査
MMRタンパク質免疫染色検査は、がん細胞を免疫染色することで、MMR タンパク質(MLH1、MSH2、MSH6、PMS2)の発現状態を調べ、dMMRかどうかを評価する検査です。
4つのMMR タンパク質(MLH1、MSH2、MSH6、PMS2)をそれぞれ検出する「ミスマッチ修復(MMR)機能欠損検出キット」が体外診断薬として保険適用となっています。
| 一般名/製品名 | 使用目的 |
| ミスマッチ修復機能欠損検出キット ベンタナ OptiView MLH1(M1) ベンタナ OptiView MSH2(G219-1129) ベンタナ OptiView MSH6(SP93) ベンタナ OptiView PMS2(A16-4) |
がん組織中のMSH2タンパクの検出 ペムブロリズマブ(遺伝子組換え)の固形がん患者さんへの適応を判定するための補助 大腸がんにおけるリンチ症候群の診断の補助 大腸癌がんにおける化学療法の選択の補助 |
NGS(次世代シークエンサー)検査
NGS検査は、DNAの塩基配列を高速で読み出し解析する装置を用いて、遺伝子の変化を調べる検査です。dMMRを対象としたNGS検査には、マイクロサテライト領域のみをターゲットとした検査と、包括的ながんゲノムプロファイリングの一環としてMMR機能を調べる検査があります。
遺伝子変異解析プログラム(がんゲノムプロファイリング検査用)として、「FoundationOne CDx」と「OncoGuide NCC オンコパネル」が保険適用となっています。
FoundationOne CDxの対象がん種、遺伝子変異、関連医薬品
| 一般名/製品名 | 使用目的 | がん種 | 遺伝子変異 | 関連委託品 |
| 遺伝子変異解析プログラム FoundationOne CDx | 固形がん患者を対象とした腫瘍組織の包括的なゲノムプロファイルの取得 | 非小細胞肺がん | 活性型EGFR遺伝子変異 | アファチニブ エルロチニブ ゲフィチニブ オシメルチニブ ダコミチニブ |
| EGFRエクソン20T790M 変異 | オシメルチニブ | |||
| ALK融合遺伝子 | アレクチニブ クリゾチニブ セリチニブ ブリグチニブ | |||
| ROS1融合遺伝子 | エヌトレクチニブ | |||
| MET遺伝子エクソン14スキッピング変異 | ダブラフェニブ トラメチニブ ジメチルスルホキシド ベムラフェニブ エンコラフェニブ ビニメチニブ | |||
| 乳がん | ERBB2コピー数異常 (HER2遺伝子増幅陽性) | トラスツズマブ | ||
| 結腸・直腸がん | KRAS/NRAS野生型 | セツキシマブ パニツムマブ | ||
| 高頻度マイクロサテライト不安定性 | ニボルマブ | |||
| 固形がん | 高頻度マイクロサテライト不安定性 | ペムブロリズマブ | ||
| 腫瘍遺伝子変異量高スコア | ペムブロリズマブ | |||
| NTRK1/2/3融合遺伝子 | エヌトレクチニブ ラロトレクチニブ | |||
| 卵巣がん | BRCA1/2遺伝子変異 | オラパリブ | ||
| 前立腺がん | BRCA1/2遺伝子変異 | オラパリブ | ||
| 胆道がん | FGFR2融合遺伝子 | ペミガチニブ |
出典:独立行政法人 医薬品医療機器総合機構 体外診断用医薬品 添付文書 FoundationOne CDx がんゲノムプロファイルより作成
dMMRの治療
遺伝子検査でMSI-Hが認められた場合、部位(血液がん以外)に関わらず、免疫チェックポイント阻害薬の効果が期待できるため、治療薬として検討されることがあります。
大腸がんを含む全固形がんを対象にペムブロリズマブの有効性・安全性を評価した第2相KEYNOTE-016 試験では、12種類のdMMR固形がん患者さん86人の治療結果が報告されており、奏効割合53%、完全奏効21%と良好な結果でした。また、無増悪生存期間、全生存期間ともに、がん種による明らかな差は認められませんでした。
また、2つの治療歴によりグループ化されたdMMR 大腸がん患者さんを対象に、ペムブロリズマブを評価した第2相KEYNOTE-164 試験が行われました。フッ化ピリミジン系薬、オキサリプラチンおよびイリノテカンによる化学療法歴がある患者さん61人の解析では、奏効割合が28%、無増悪生存期間の中央値が、2.3か月で良好な結果でした。また、奏効が得られた患者さんの82%で6か月以上の奏効期間が認められました。
同様に、標準治療不応・不耐のdMMR 進行固形がん患者さん94人を対象に、ペムブロリズマブを評価した第2相KEYNOTE-158 試験では、奏効割合 37%、無増悪生存期間の 中央値が5.4か月、全生存期間の中央値が13.4か月と良好な結果で、がん種を問わず効果が認められました。また、奏効が得られた患者さんの51%で6か月以上の奏効期間が認められ、効果が持続することも合わせて示されました。
KEYNOTE-164 試験(コホートA)とKEYNOTE-158 試験の結果を基に、「大腸がんを含む標準治療抵抗性もしくは標準治療のないdMMR固形がん」に対する効能または効果で、ペムブロリズマブが2018 年12 月に国内承認されました。
成人・小児進行固形がんにおける臓器横断的ゲノム診療のガイドライン第3版では、「有効性・安全性の観点から免疫チェックポイント阻害薬の臓器特異的な適応が得られていない固形がんを含め、全てのdMMR固形がん患者さんに対して、免疫チェックポイント阻害薬は有力な治療選択肢となり得る」とされており、切除不能進行・再発固形がん患者さんに対して、免疫チェックポイント阻害薬の適応を判断するためにdMMR検査を行うことが、強く推奨されています。
ただし、がん種によっては治療戦略の決定に必要なバイオマーカー検査(大腸がん:RAS/BRAF 検査、胃がん:HER2検査、非小細胞肺がん:EGFR、ALK、ROS1 、PD-L1発現検査など)があるため、バイオマーカー検査を優先することが考慮されます。
保険適用されている免疫チェックポイント阻害薬一覧
| 一般名(製品名) | 標的 | 適応 |
| ニボルマブ (オプジーボ) | 抗PD-1抗体 | 性黒色腫 切除不能な進行・再発の非小細胞肺がん 非小細胞肺がんにおける術前補助療法 根治切除不能または転移性の腎細胞がん 再発または難治性の古典的ホジキンリンパ腫 再発または遠隔転移を有する頭頸部がん 治癒切除不能な進行・再発の胃がん 切除不能な進行・再発の悪性胸膜中皮腫 がん化学療法後に増悪した治癒切除不能な進行・再発の高頻度マイクロサテライト不安定性(MSI-High)を有する結腸・直腸がん 根治切除不能な進行・再発の食道がん 食道がんにおける術後補助療法 原発不明がん 尿路上皮がんにおける術後補助療法 |
| ペムブロリズマブ (キイトルーダ) | 抗PD-1抗体 | 悪性黒色腫 切除不能な進行・再発の非小細胞肺がん 再発または難治性の古典的ホジキンリンパ腫 がん化学療法後に増悪した根治切除不能な尿路上皮がん がん化学療法後に増悪した進行・再発の高頻度マイクロサテライト不安定性(MSI-High)を有する固形がん(標準的な治療が困難な場合に限る) 根治切除不能または転移性の腎細胞がん 腎細胞がんにおける術後補助療法 再発または遠隔転移を有する頭頸部がん 根治切除不能な進行・再発の食道がん 治癒切除不能な進行・再発の高頻度マイクロサテライト不安定性(MSI-High)を有する結腸・直腸がん PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能または再発乳がん ホルモン受容体陰性かつHER2陰性で再発高リスクの乳がんにおける術前・術後薬物療法 がん化学療法後に増悪した切除不能な進行・再発の子宮体がん がん化学療法後に増悪した高い腫瘍遺伝子変異量(TMB-High)を有する進行・再発の固形がん(標準的な治療が困難な場合に限る) 進行または再発の子宮頸がん |
| デュルバルマブ (イミフィンジ) | 抗PD-L1抗体 | 切除不能な局所進行の非小細胞肺がんにおける根治的化学放射線療法後の維持療法 切除不能な進行・再発の非小細胞肺がん 進展型小細胞肺がん 切除不能な肝細胞がん 治癒切除不能な胆道がん |
| アテゾリズマブ (テセントリク) | 抗PD-L1抗体 | 切除不能な進行・再発の非小細胞肺がん PD-L1陽性の非小細胞肺がんにおける術後補助療法 進展型小細胞肺がん 切除不能な肝細胞がん PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能または再発乳がん |
| アベルマブ (バベンチオ) | 抗PD-L1抗体 | 根治切除不能なメルケル細胞がん 根治切除不能または転移性の腎細胞がん 根治切除不能な尿路上皮がんにおける化学療法後の維持療法 |
| セミプリマブ (リブタヨ) | 抗PD-1抗体 | がん化学療法後に増悪した進行または再発の子宮頸がん |
| イピリムマブ (ヤーボイ) | 抗CTLA-4抗体 | 根治切除不能な悪性黒色腫 根治切除不能または転移性の腎細胞がん がん化学療法後に増悪した治癒切除不能な進行・再発の高頻度マイクロサテライト不安定性(MSI-High)を有する結腸・直腸がん 切除不能な進行・再発の非小細胞肺がん 切除不能な進行・再発の悪性胸膜中皮腫 根治切除不能な進行・再発の食道がん |
| トレメリムマブ (イジュド) | 抗CTLA-4抗体 | 切除不能な進行・再発の非小細胞肺がん 切除不能な肝細胞がん |
※太文字は、MSI-HとTMB-Hが認められる場合に使用可能
NTRK
NTRK遺伝子は、神経細胞の分化や維持に関わるTRKタンパク質の設計図となる遺伝子で、がんの治療標的として「NTRK遺伝子のミスセンス変異」と「NTRK融合遺伝子」が重要とされています。
NTRK遺伝子の変化は、「大腸がん」「肺がん」「悪性黒色腫」「急性白血病」などで認められています。また、NTRK遺伝子増幅は「乳がん」「皮膚基底細胞がん」「肺がん」などで認められています。
NTRK融合遺伝子は、さまざまながん種で高頻度に認められていますが、「唾液腺分泌がん」「乳腺分泌がん」「乳児型線維肉腫」「先天性間葉芽腎腫」などを除き、一般的に頻度は低いとされています。
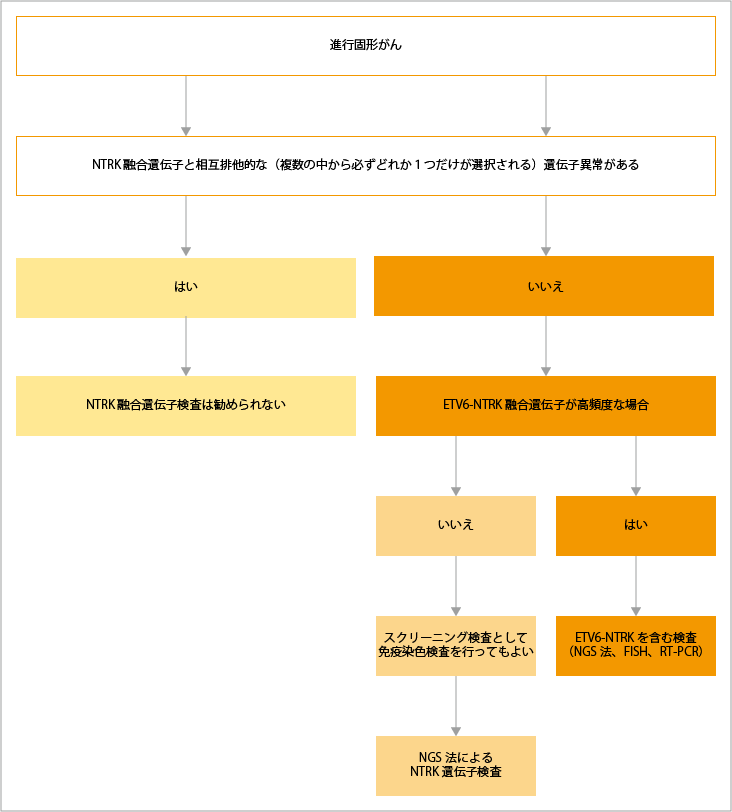
NTRK融合遺伝子検査
NTRK融合遺伝子検査には、「次世代シークエンサー(NGS)法」「RT-PCR」「ISH」「IHC」などがあります。NGS法としては、「OncoGuide NCC オンコパネルシステム」「FoundationOne CDx がんゲノムプロファイル」が承認されています。
TRK阻害薬
現在、TRK阻害薬は「エヌトレクチニブ(ロズリートレク)」「ラロトレクチニブ(ヴァイトラックビ)」の2つが国内承認されています。
エヌトレクチニブは、TRK(およびALK)とROS1を阻害するチロシンキナーゼ阻害薬です。2019年6月に「NTRK融合遺伝子陽性の進行・再発の固形がん」の効能・効果で国内承認されました。
ラロトレクチニブは、TRKを阻害するチロシンキナーゼ阻害薬です。2021年3月に、「NTRK融合遺伝子陽性の進行・再発の固形がん」の効能・効果で国内承認されました。
TRK阻害薬は、NTRK融合遺伝子陽性の固形がんに対して有効性が認められていますが、NTRK遺伝子のその他の異常(遺伝子変異、遺伝子増幅など)に対しては、効果が確立されていないため、現時点では臨床試験以外での使用は推奨されていません。
TMB-H
腫瘍遺伝子変異量(tumor mutation burden:TMB)は、がん細胞が持つ体細胞遺伝子変異の量のことで,100 万塩基当たりの遺伝子変異数(mut/Mb)を単位として表されます。体細胞変異の蓄積によりTMBが高くなっていることをTMB-High(TMB-H)といい、免疫応答を誘導する腫瘍特異抗原(ネオアンチゲン)が多く作られるため、免疫細胞(T細胞)に認識されやすくなると考えられています。また、免疫チェックポイント阻害約の治療効果を予測するバイオマーカーとなっています。
TMB-Hのがん種別頻度
遺伝子パネル検査「FoundationOne CDx」を用いた研究によると、20mut/Mb以上のTMBがあると、がんの発生割合は約0.93~54.6%で、TMB-H固形がんは予後が悪いと報告されています。
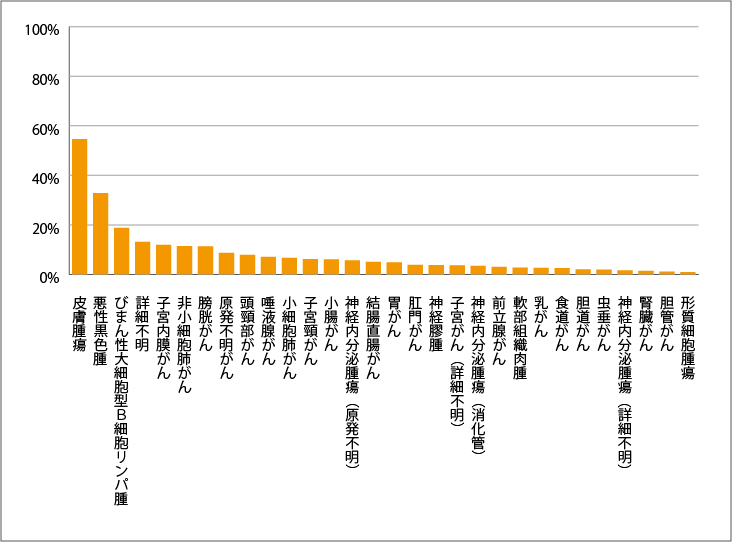
TMB-H固形がん発生頻度
| がん種 | 頻度 |
| 皮膚腫瘍 | 54.60% |
| 悪性黒色腫 | 32.88% |
| びまん性大細胞型B細胞リンパ腫 | 18.85% |
| 詳細不明 | 13.11% |
| 子宮内膜がん | 11.94% |
| 非小細胞肺がん | 11.47% |
| 膀胱がん | 11.36% |
| 原発不明がん | 8.70% |
| 頭頸部がん | 7.95% |
| 唾液腺がん | 7.07% |
| 小細胞肺がん | 6.72% |
| 子宮頸がん | 6.14% |
| 小腸がん | 6.13% |
| 神経内分泌腫瘍(原発不明) | 5.70% |
| 結腸直腸がん | 5.10% |
| 胃がん | 4.86% |
| 肛門がん | 3.85% |
| 神経膠腫 | 3.72% |
| 子宮がん(詳細不明) | 3.70% |
| 神経内分泌腫瘍(消化管) | 3.49% |
| 前立腺がん | 3.05% |
| 軟部組織肉腫 | 2.76% |
| 乳がん | 2.61% |
| 食道がん | 2.53% |
| 胆道がん | 2.06% |
| 虫垂がん | 1.98% |
| 神経内分泌腫瘍(詳細不明) | 1.69% |
| 腎臓がん | 1.49% |
| 胆管がん | 1.15% |
| 形質細胞腫瘍 | 0.93% |
出典:成人・小児進行固形がんにおける臓器横断的ゲノム診療のガイドライン第3版.IV TMB-Hを有する固形がん.表8-2 がん種別TMB‒H(TMB≥20 mut/Mb)より作成
TMB検査
TMBを調べるために、NGS法による検査が行われます。現在、同検査を目的に国内承認されている遺伝子検査パネルは、以下の3つです。
- FoundationOne CDx
- FoundationOne Liquid CDx
- Guardant360 CDx
TMB-H固形がんの治療
TMBが増加・蓄積すると、免疫応答を誘導する腫瘍特異抗原(ネオアンチゲン)が多く作られ、T細胞に認識されやすくなると考えられています。そのため、TMB-H固形がんでは、免疫チェックポイント阻害薬による、抗腫瘍効果が期待されています。
成人・小児進行固形がんにおける臓器横断的ゲノム診療のガイドラインでは、「TMB-Hを有する切除不能・転移・再発固形がんに対して免疫チェックポイント阻害薬の投与を推奨」とされています。
化学療法後に増悪した進行・再発の固形がんに対し、FoundationOne CDxでTMB スコアを測定し、ペムブロリズマブの有効性を検証したKEYNOTE-158 試験では、TMB-H(10 mut/Mb以上)はTMB-L(10 mut/Mb未満)と比較して高い奏効率が認められました。
免疫チェックポイント阻害薬は、悪性黒色腫、肺がん、膀胱がんなど、TMB-Hに対し高い抗腫瘍効果を示すがん種がある一方で、乳がん、前立腺がん、神経膠腫などでは、TMBと免疫チェックポイント阻害薬の効果が相関しないことが報告されており、がん種によってはTMB が免疫チェックポイント阻害薬の効果を予測できない可能性が示唆されています。また、がん種によって最適なTMB値が異なる可能性があるため、さらなる検証が必要とされています。
BRAF
RAF遺伝子は、細胞増殖に関わる遺伝子です。RAF遺伝子には、「ARAF」「BRAF」「CRAF」の3つがあります。このうち、遺伝子の変化(遺伝子変異)が確認されているのは主にBRAF遺伝子で、悪性黒色腫、甲状腺がん、大腸がん、肺がんなどのがん種で確認されています。
BRAF遺伝子変異に対する治療薬は、現在5種類の薬剤が承認されています。
BRAF遺伝子変異を対象とする承認薬
| 一般名(製品名) | 効能または効果 |
| ベムラフェニブ (ゼルボラフ) | BRAF遺伝子変異を有する根治切除不能な悪性黒色腫 |
| ダブラフェニブ (タフィンラー) | BRAF遺伝子変異を有する根治切除不能な悪性黒色腫 BRAF遺伝子変異を有する切除不能な進行・再発の非小細胞肺がん |
| エンコラフェニブ (ビラフトビ) | BRAF遺伝子変異を有する根治切除不能な悪性黒色腫 がん化学療法後に増悪したBRAF遺伝子変異を有する切除不能な進行・再発の結腸・直腸がん |
| トラメチニブ (メキニスト) | BRAF遺伝子変異を有する根治切除不能な悪性黒色腫 BRAF遺伝子変異を有する切除不能な進行・再発の非小細胞肺がん |
| ビニメチニブ (メクトビ) | BRAF遺伝子変異を有する根治切除不能な悪性黒色腫 がん化学療法後に増悪したBRAF遺伝子変異を有する切除不能な進行・再発の結腸・直腸がん |
出典:成人・小児進行固形がんにおける臓器横断的ゲノム診療のガイドライン第3版.V その他.表10-2 BRAF遺伝子変異を対象とする承認薬より作成
HER2
HER2遺伝子は、ERBB2ともいい、HER2タンパク質を作り出す遺伝子です。「乳がん」「胃がん」「膀胱がん」などで、HER2遺伝子増幅やHER2タンパク質の過剰発現が認められており、特に乳がんで頻度が高いという報告があります。
HER2の検査
HER2タンパク質の過剰発現を調べるには、免疫組織化学検査が行われます。腫瘍組織を染色することでタンパク質の一部である抗原を可視化する検査です。
HER2に対する治療
HER2遺伝子増幅・タンパク質過剰発現がある乳がんの治療薬として国内承認されている薬剤は、5種類あります。
| 一般名(製品名) | 薬剤タイプ |
| トラスツズマブ(ハーセプチン) | モノクローナル抗体 |
| ペルツズマブ(パージェダ) | モノクローナル抗体 |
| トラスツズマブ エムタンシン(カドサイラ) | 抗体薬物複合体 |
| トラスツズマブ デルクステカン(エンハーツ) | 抗体薬物複合体 |
| ラパチニブ(タイケルブ) | チロキシンキナーゼ阻害薬 |
トラスツズマブは、HER2陽性の乳がんの治療成績を大幅に改善しました。HER2陽性の胃がんに対しては、トラスツズマブのみが承認されていましたが、トラスツズマブ デルクステカンも2 レジメン以上の治療歴がある患者さんに対して、標準的な化学療法と比較して高い奏効率、生存期間の延長が認められため、2021 年に国内承認されました。
HER2陽性の唾液腺がんに対しては、トラスツズマブ+ドセタキセル併用療法で、高い奏効率および臨床的有用率、長期の無増悪生存期間、生存期間が認められたため、2021 年に国内承認されました。
FGFR
線維芽細胞受容体(FGFR)は、FGFR1~4まで4つのサブタイプがあります。このうち、FGFR2 は、「PI3K/AKT経路」「RAS/RAF/MAPK 経路」などのシグナル伝達を介することで、がんの増殖、生存、血管新生、薬剤耐性、免疫回避などに関与すると考えられています。次世代シークエンサーを用いたFGFR 遺伝子解析の結果、7.1%にFGFR遺伝子異常(増幅66%、変異26%、再構成8%)が認められ、サブタイプ別の頻度はFGFR1(49%)、FGFR3(26%)、FGFR2(19%)、FGFR4(7%)でした。
がん種別の頻度は,尿路上皮がん(32%)、乳がん(17%)、子宮内膜がん(11%)、卵巣がん(9%)、原発不明がん(8%)、グリオーマ(8%)、胆管がん(7%)、胃がん(7%)、非小細胞肺がん(5%)、膵臓がん、頭頸部扁平上皮がん、大腸がん、肉腫(4~5%)でした。
FGFRの治療
FGFRを標的とした治療薬は、「エルダフィチニブ」「ペミガチニブ(ペマジール)」「インフィグラチニブ」「フチバチニブ」の4剤があります。このうち、ペミガチニブが「がん化学療法後に増悪したFGFR2融合遺伝子陽性の治癒切除不能な胆道がん」と「FGFR1融合遺伝子陽性の骨髄性またはリンパ性腫瘍」の効能・効果で国内承認されています。また、フチバチニブは、「前治療歴を有するFGFR2融合遺伝子を含む遺伝子再構成を伴う局所進行または転移性胆道がん」に対する治療薬として、国内申請中です。
FGFR阻害薬一覧
| 一般名(製品名) | 標的 | がん種 | 遺伝子変化 | 国内 | 米国 |
| エルダフィチニブ (BALVERSA) | FGFR1~4 | 尿路上皮がん | FGFR3変異 FGFR2/3融合 | 未承認 | 承認 |
| ペミガチニブ (ペマジール) | FGFR1~3 | 胆道がん 骨髄性またはリンパ性腫瘍 | FGFR2融合 | 承認 | 承認 |
| インフィグラチニブ (Truseltiq) | FGFR1~3 | 胆道がん | FGFR2融合 | 未承認 | 承認 |
| フチバチニブ (Lytgobi) | FGFR1~4 | 胆道がん | FGFR2融合 | 申請中 | 承認 |
出典:成人・小児進行固形がんにおける臓器横断的ゲノム診療のガイドライン第3版.V その他.表10-3 選択的FGFR阻害剤より作成
RAS
RAS遺伝子は、細胞増殖を促進するシグナルを細胞内で伝達するRASタンパク質の設計図となる遺伝子です。RAS遺伝子に異常があると、細胞増殖シグナルが活性化し、発がんやがんの増殖が起こると考えられています。
RAS遺伝子には、「KRAS遺伝子」「NRAS遺伝子」「HRAS遺伝子」の3つがあり、それぞれ「KRASタンパク質」「NRASタンパク質」「HRASタンパク質」の設計図となります。3つのRAS遺伝子のうち、KRAS遺伝子変異が最も多くのがん種で認められています。
さらに、KRAS遺伝子変異の中で最も多いのが「KRAS G12C」というサブタイプで、非小細胞肺がんの約13%、大腸がんの約3%、膵臓がん・子宮内膜がん・膀胱がん・卵巣がん・小細胞肺がんなどの約1~2%で認められています。
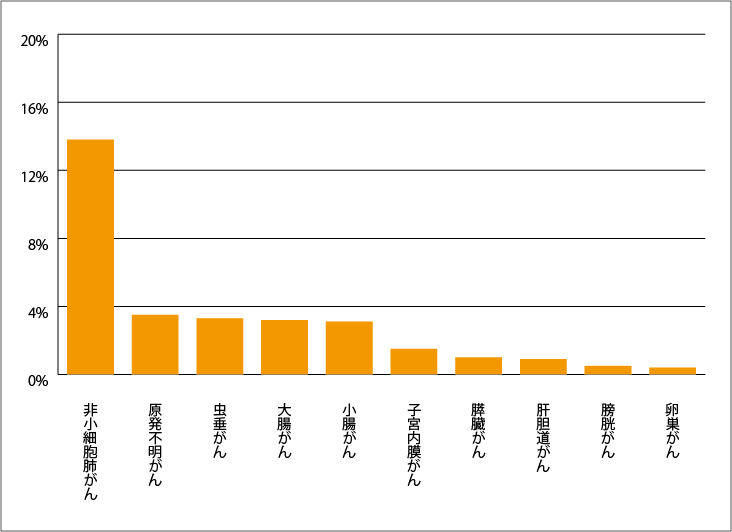
KRASの治療
KRAS G12C阻害薬ソトラシブ(ルマケラス)が、「がん化学療法後に増悪したKRAS G12C変異陽性の切除不能な進行・再発の非小細胞肺がん」の効能・効果で2022年1月に承認されました。
また、KRAS G12C陽性の非小細胞肺がん患者さんを特定するためのコンパニオン診断として、「Guardant360 CDxがん遺伝子パネル」「therascreen KRAS 変異検出キット RGQ 「キアゲン」」が承認されています。
| 検査名 | 遺伝子変化 | がん種 | 治療薬 |
| Guardant360 CDxがん遺伝子パネル | KRAS G12C | 非小細胞肺がん | ソトラシブ |
| MSI-High | 結腸・直腸がん | ニボルマブ | |
| 固形がん | ペムブロリズマブ | ||
| therascreen KRAS 変異検出キット RGQ 「キアゲン」 | KRAS G12C | 非小細胞肺がん | ソトラシブ |
BRCA1/2
BRCA1遺伝子とBRCA2遺伝子は、細胞の急激な増殖や無秩序な増殖を防ぐために働く「がん抑制遺伝子」で、それぞれBRCA1/BRCA2タンパク質の設計図となります。
DNAは、紫外線や放射線などにより、一部が切断されることがあります。BRCA1/BRCA2タンパク質は、切断されたDNAを修復する役割があるため、BRCA1/2遺伝子に、があると、BRCA1/BRCA2タンパク質が正しく機能しない、もしくは作られなくなるような変化があると、DNAの修復が行われず、がんが発症しやすくなります。
BRCA1/2遺伝子の変化に関連したがん種としては、遺伝性乳がん卵巣がん(HBOC)のほか、前立腺がん、膵臓がんなどが臓器横断的に認められています。がん遺伝子パネル検査の解析を行った研究では、BRCA1/2遺伝子の変化が全体の4.7%で認められたという報告があります。
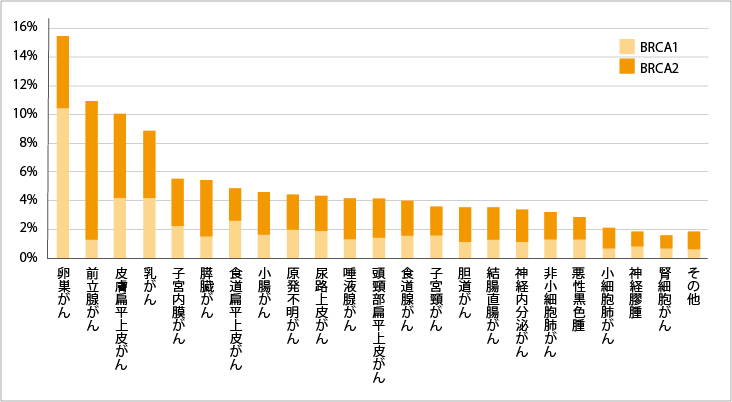
BRCA1/2の治療
BRCA1/2に関連したがん種では、PARP阻害薬の効果が期待できます。PARP(poly ADP-ribose polymerase)は、DNAの修復、細胞死、分化制御などに関わる物質です。DNAは、2本の鎖がらせん状にお互い巻き付いた構造となっています。1本の鎖が切断された場合は、PARPが修復し、2本とも切断された場合は、BRCA1/2などの働きにより修復されます。
BRCA1/2遺伝子変異がある乳がん卵巣がんなどでは、BRCAの働きが失われているため、DNAの2本鎖が切断された状態を修復できず、がん細胞が発生します。がん細胞は、PARPが働ける限り、その後DNAの1本の鎖が切断されてもその部分を修復して生き残ります。そこで、PARPを阻害すると、1本の鎖が切断された時点で修復することができず、やがてその部分の2本目の鎖も切断されます。このがん細胞でDNAが2本切断されると、BRCA1/2はもともと働いていなかったので、細胞はやがて死んでいきます。PARP阻害薬は、このような仕組みで細胞死を誘導し抗腫瘍効果を発揮するのが狙いの薬です。
こうしたPARP阻害薬として、「オラパリブ(リムパーザ)」と「ニラパリブ(ゼジューラ)」が承認されています。
| 一般名 (製品名) | 標的 | 適応 |
| オラパリブ (リムパーザ) | PARP | 白金系抗悪性腫瘍剤感受性の再発卵巣がんにおける維持療法 BRCA遺伝子変異陽性の卵巣がんにおける初回化学療法後の維持療法 相同組換え修復欠損を有する卵巣がんにおけるベバシズマブ(遺伝子組換え)を含む初回化学療法後の維持療法 がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能または再発乳がん BRCA遺伝子変異陽性かつHER2陰性で再発高リスクの乳がんにおける術後薬物療法 BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺がん BRCA遺伝子変異陽性の治癒切除不能な膵がんにおける白金系抗悪性腫瘍剤を含む化学療法後の維持療法 |
| ニラパリブ (ゼジューラ) | PARP | 卵巣がんにおける初回化学療法後の維持療法 白金系抗悪性腫瘍剤感受性の再発卵巣がんにおける維持療法 白金系抗悪性腫瘍剤感受性の相同組換え修復欠損を有する再発卵巣がん |
ALK
ALK遺伝子は、細胞の増殖に関わるALKタンパク質の設計図となる遺伝子です。ALK遺伝子が傷つき、ほかの遺伝子と融合するとALK融合遺伝子になり、異常なタンパク質(ALK融合タンパク質)が作られます。ALK融合遺伝子があるがん細胞では、細胞表面にALK融合タンパク質が発現し、ここに「ATP(アデノシン3リン酸)」という物質が結合すると、ALK融合タンパク質が活性化し、がん細胞を増殖させるシグナルを出します。このシグナルが、最終的にはがん細胞の核に伝わり、がん細胞を増殖させます。
11万4,200 人の遺伝子パネル検査結果についての調査では,非小細胞肺がん3.1%、非小細胞肺がんを除く固形がん0.2%で、ALK 融合遺伝子が認められました。ALK 融合遺伝子が認められたがん種は、乳がん、大腸がん、リンパ腫、卵巣がん、膵臓がん、炎症性筋線維芽細胞性腫瘍、平滑筋肉腫、軟部肉腫、甲状腺乳頭がん、原発不明がん、子宮肉腫などでした。
ALK融合遺伝子の治療
ALK融合遺伝子陽性のがんに対する治療では、ALK阻害薬という分子標的薬が使用されます。ALK阻害薬は、ALK融合タンパク質と結合することで、ATPとALK融合タンパク質との結合を阻害します。ALK融合タンパク質は、ALK阻害薬が結合するとATPが結合できないため活性化できず、がん細胞を増殖させるシグナルを出さなくなり、がん細胞の増殖を抑制します。こうして、腫瘍縮小効果が発揮されると考えられています。
ALK融合遺伝子陽性のがんに対しては、「クリゾチニブ(ザーコリ)」「アレクチニブ(アレセンサ)」「セリチニブ(ジカディア)」「ブリグチニブ(アルンブリグ)」「ロルラチニブ(ローブレナ)」の5剤が承認されています。
ALK阻害薬
| 一般名(製品名) | 適応 |
| クリゾチニブ (ザーコリ) | ALK融合遺伝子陽性の切除不能な進行・再発の非小細胞肺がん ROS1融合遺伝子陽性の切除不能な進行・再発の非小細胞肺がん |
| アレクチニブ (アレセンサ) | ALK融合遺伝子陽性の切除不能な進行・再発の非小細胞肺がん 再発または難治性のALK融合遺伝子陽性の未分化大細胞リンパ腫 |
| セリチニブ (ジカディア) | ALK融合遺伝子陽性の切除不能な進行・再発の非小細胞肺がん |
| ブリグチニブ (アルンブリグ) | ALK融合遺伝子陽性の切除不能な進行・再発の非小細胞肺がん |
| ロルラチニブ (ローブレナ) | ALK融合遺伝子陽性の切除不能な進行・再発の非小細胞肺がん |
参考文献:
成人・小児進行固形がんにおける臓器横断的ゲノム診療のガイドライン第3版2022年2月
Haricharan S, Bainbridge MN, Scheet P et al. Somatic mutation load of estrogen receptor-positive breast tumors predicts overall survival:an analysis of genome sequence data. Breast Cancer Res Treat. 2014;146:211-220.

