がん遺伝子検査ってなに 遺伝子異常と分子標的薬のマッチングがつくるがん治療の未来

2018.12 取材・文:柄川昭彦
がんゲノム医療の時代が始まろうとしています。それに伴い、がん細胞における数百の遺伝子を一度に調べる遺伝子パネル検査が開発され、広く実用化される一歩手前の段階まできています。東京大学が開発した「東大オンコパネル(Todai OncoPanel)」は、がんに関連する464遺伝子のDNAと、463遺伝子のRNAを調べる検査で、2018年8月から先進医療Bとして実施され、この検査を受けたことによって治療選択に役立つ情報が得られた患者さんがどれくらいいたかが検証されます。今後の日本のがん医療のためにも、日本で開発された遺伝子パネル検査が承認されることが期待されています。
がん遺伝子と分子標的薬
がんの治療が大きく変わろうとしています。現在注目を集めているのは、がん細胞の遺伝子を調べ、得られた遺伝子情報の解析に基づいて行われるゲノム医療です。従来のがん治療は、肺がん、胃がん、大腸がんというように、臓器別の分類に基づいて行われてきましたが、がんゲノム医療では、1人ひとりのがんの遺伝子情報に基づいて治療が進められることになるため、遺伝子を調べる優れた検査方法が不可欠です。
がん細胞の遺伝子を調べる「東大オンコパネル(Todai OncoPanel)」は、東京大学で開発された検査方法で、2018年8月から先進医療Bの枠組みで実施されています。Todai OncoPanelの性能が試され、その結果次第では、薬事承認、保険収載へと進み、将来的には保険で受けられる検査になる可能性があります。がん治療の新しい時代が始まろうとしていると言っていいでしょう。
がんに対して遺伝子情報に基づく治療が行われるようになったのは、がんが遺伝子の異常によって起こる病気だからです。がん細胞では、さまざまな遺伝子変異が生じています。そして、遺伝子の中には、細胞の増殖や細胞の生死にかかわるタンパク質を作っているものがあり、それが遺伝子変異により正しく働かなくなることで、無秩序に増殖を続けるがん細胞を生み出してしまいます。
こうした遺伝子変異の働きをブロックする作用をもつ薬が、がんの治療で使われている「分子標的薬」です。がん化にかかわる遺伝子の異常に働きかけることで、がん細胞の増殖を抑え、治療効果を発揮します。
分子標的薬が登場する前から使われていた従来の抗がん剤は、基本的に細胞を傷害する薬で、がん細胞にも正常細胞にも作用します。ただし、抗がん剤が毒性を発揮するのは細胞分裂が行われるときで、正常細胞よりも早く増殖するがん細胞のほうが、大きなダメージを受けます。それによって治療効果が発揮されます。しかし、正常細胞も傷害されるため、強い副作用を伴うことになります。
その点、分子標的薬は、標的とする遺伝子変異がある細胞だけに働きかけるので、従来の抗がん剤のような副作用は現れません。薬剤によって特徴的な症状が現れることもありますが、殺細胞性の抗がん剤より副作用は比較的軽いと言われています。
しかし、分子標的薬が標的とする遺伝子の変異がないと効果がありません。そのため、分子標的薬は、患者さんのがん細胞に標的があることを検査で確認してから使用します。たとえば、肺がんの薬物療法を行うときには、がん細胞のEGFRという遺伝子に変異があるかどうかを調べます。変異がある場合には、それががんの増殖にかかわっていると考えられるため、EGFRを標的としてゲフィチニブ(製品名:イレッサ)などの分子標的薬が使われることになります。同じ肺がん患者さんでも、EGFR遺伝子変異ではなくALK融合遺伝子がある場合は、ALK融合遺伝子を標的としたクリゾチニブ(製品名:ザーコリ)などが使われます。このように、遺伝子変異の違いにより、同じ肺がんでも使われる薬が異なります。がんの遺伝子に合わせて治療薬を使い分けることで、無駄な治療をせず、効果が期待できる治療選択ができるわけです。
乳がんや胃がんでは、がん細胞にHER2というタンパク質が増えているかどうかを調べます。HER2が増えていれば、それががんの増殖にかかわっていると考えられるので、HER2を標的としてトラスツズマブ(製品名:ハーセプチン)などの分子標的薬が使われます。がん種(がんのできた部位)にかかわらず、HER2陽性であれば、HER2を標的とした分子標的薬が使われます。
分子標的薬は、すでに数十種類の薬が、がんの治療に使われています(表1参照)。そして、肺がんでEGFRの変異があればゲフィチニブなどのEGFR阻害薬を使用する、乳がんでHER2が発現していればトラスツズマブなどの抗HER2薬を使う、といった具合に、特定のがん種で、特定の遺伝子の異常があれば、特定の分子標的薬が使われることになっています。分子標的薬はこのように使用されてきました。
表1 がん治療の主な分子標的薬と標的分子
| 分類 | 一般名(製品名) | 主な標的分子 | 適用のある主ながん腫 |
|---|---|---|---|
| EGFR阻害薬 | ゲフィチニブ(イレッサ) | EGFR | 非小細胞肺がん |
| エルロチニブ(タルセバ) | 非小細胞肺がん、膵がん | ||
| アファチニブ(ジオトリフ) | 非小細胞肺がん | ||
| オシメルチニブ(タグリッソ) | 非小細胞肺がん | ||
| HER2阻害薬 | ラパチニブ(タイケルブ) | HER2 | 乳がん |
| BCR/ABL阻害薬 | イマチニブ(グリベック) | BCR/ABL | 慢性骨髄性白血病、消化管間質腫瘍、急性リンパ性白血病、慢性好酸球性白血病 |
| ニロチニブ(タシグナ) | 慢性骨髄性白血病 | ||
| ダサチニブ(スプリセル) | 慢性骨髄性白血病、急性リンパ性白血病 | ||
| ボスチニブ(ボシュリフ) | 慢性骨髄性白血病 | ||
| ポナチニブ(アイクルシグ) | 慢性骨髄性白血病、急性リンパ性白血病 | ||
| VEGFR阻害薬 | アキシチニブ(インライタ) | VEGFR-1,2,3 | 腎細胞がん |
| マルチキナーゼ阻害薬 | ソラフェニブ(ネクサバール) | VEGFR、PDGFR、Raf | 腎細胞がん、幹細胞がん、甲状腺がん |
| スニチニブ(スーテント)/td> | PDGFR、VEGFR、Raf | 消化管間質腫瘍、腎細胞がん、神経内分泌腫瘍 | |
| パゾパニブ(ヴォトリエント) | VEGFR、PDGFR、KIT | ||
| レゴラフェニブ(スチバーガ) | VEGFR、KIT、PDGFR、RET | 大腸がん、消化管間質腫瘍、肝細胞がん | |
| バンデタニブ(カプレルサ) | VEGFR、EGFR、RET | 甲状髄様がん | |
| レンバチニブ(レンビマ) | VEGFR、EGFR、RET、KIT、PDGFR | 甲状腺がん、肝細胞がん | |
| VEGF阻害薬 | アフリベルセプト(ザルトラップ) | VEGF-A/B、PIGF | 大腸がん |
| プロテアソーム阻害薬 | ボルテゾミブ(ベルケイド) | プロテアソーム | 多発性骨髄腫、マントル細胞リンパ腫 |
| カルフィルゾミブ(カイプロリス) | 多発性骨髄腫 | ||
| イキサゾミブ(ニンラーロ) | 多発性骨髄腫 | ||
| ALK阻害薬 | クリゾチニブ(ザーコリ) | ALK | 非小細胞肺がん |
| アレクチニブ(アレセンサ) | |||
| セリチニブ(ジカディア) | |||
| ロルラチニブ(ローブレナ) | |||
| BTK阻害薬 | イブルチニブ(イムブルビカ) | BTK | 慢性リンパ性白血病、マントル細胞リンパ腫 |
| BRAF阻害薬 | ベムラフェニブ(ゼルボラフ) | BRAF | 悪性黒色腫 |
| ダブラフェニブ(タフィンラー) | 悪性黒色腫、非小細胞肺がん | ||
| MEK阻害薬 | トラメチニブ(メキニスト) | MEK | 悪性黒色腫 |
| mTOR阻害薬 | エベロリムス(アフィニトール) | mTOR | 腎細胞がん、神経内分泌腫瘍、乳がん |
| テムシロリムス(トーリセル) | 腎細胞がん | ||
| CDK4/6阻害薬 | パルボシクリブ(イブランス) | CDK4/6 | 乳がん |
| アベマシクリブ(ベージニオ) | |||
| PNP阻害薬 | フォロデシン(ムンデシン) | PNP | 末梢性T細胞リンパ腫 |
| FLT3阻害薬 | ギルテリチニブ(ゾスパタ) | FLT3 | 急性骨髄性白血病 |
| PARP阻害薬 | オラパリブ(リムパーザ) | PARP | 卵巣がん、乳がん |
| レチノイド | トレチノイン(ベノサイド) | PML-RAR | 急性全骨髄球性白血病 |
| タミバロテン(アムノレイク)/td> | |||
| ベキサロテン(タルグレチン) | レチノイド | 皮膚T細胞性リンパ腫 | |
| HDAC阻害薬 | ボリノスタット(ゾリンザ) | HDAC | 皮膚T細胞性リンパ腫 |
| ハノビノスタット(ファリーダック) | 多発性骨髄腫 | ||
| ロミデプシン(イストダックス) | 末梢性T細胞リンパ腫 | ||
| 抗EGFR抗体 | セツキシマブ(アービタックス) | EGFR | 大腸がん、頭頸部がん |
| パニツムマブ(ベクティビックス) | 大腸がん | ||
| 抗HER2抗体 | トラスツズマブ(ハーセプチン) | HER2 | 乳がん、胃がん |
| ペルツズマブ(パージェタ) | 乳がん | ||
| トラスツズマブ エムタンシン(カドサイラ) | |||
| 抗VEGF抗体 | ベバシズマブ(アバスチン) | VEGF | 大腸がん、非小細胞肺がん、乳がん、悪性神経膠腫、卵巣がん、子宮頸がん |
| 抗VEGFR抗体 | ラムシルマブ(サイラムザ) | VEGFR-2 | 胃がん、大腸がん、非小細胞肺がん |
| 抗CD20抗体 | リツキシマブ(リツキサン) | CD20 | B細胞性非ホジキンリンパ腫、など |
| オファツムマブ(アーゼラ) | 慢性リンパ性白血病 | ||
| オビヌツズマブ(ガザイバ) | 濾胞性リンパ腫 | ||
| 抗CD52抗体 | アレムツズマブ(マブキャンパス) | CD52 | 慢性リンパ性白血病 |
| 抗CD33抗体 | ゲムツズマブオゾガマイシン(マイロターグ) | CD33 | 急性骨髄性白血病 |
| 抗CCR4抗体 | モガリズマブ(ポテリジオ) | CCR4 | 成人T細胞白血病リンパ腫、末梢性T細胞リンパ腫、皮膚T細胞リンパ腫 |
| 抗CD30抗体 | ブレンツキシマブデドチン(アドセトリス) | CD30 | ホジキンリンパ腫、未分化大細胞リンパ腫 |
| 抗CD38抗体 | ダラツムマブ(ダラザレックス) | CD38 | 多発性骨髄腫 |
| 抗CD22抗体 | イノツズマブオゾガマイシン(ベスポンサ) | CD22 | 急性リンパ性白血病 |
| 免疫チェックポイント阻害薬 | ニボルマブ(オプジーボ) | PD-1 | 悪性黒色腫、非小細胞肺がん、腎細胞がん、古典的ホジキンリンパ腫、頭頸部がん、胃がん、悪性胸膜中皮腫 |
| ペムブロリズマブ(キイトルーダ) | 悪性黒色腫、非小細胞肺がん、古典的ホジキンリンパ腫、尿路上皮がん | ||
| アベルマブ(バベンチオ) | PD-L1 | メルケル細胞がん | |
| デュルバルマブ(イミフィンジ) | 非小細胞肺がん | ||
| アテゾリズマブ(テセントリク) | |||
| イピリムマブ(ヤーボイ) | CTLA-4 | 悪性黒色腫、腎細胞がん | |
| BiTE抗体薬 | ブリナツモマブ(ビーリンサイト) | CD19、CD3 | B細胞性急性リンパ性白血病 |
| 抗SLAMF7抗体 | エロツズマブ(エムプリシティ) | SLAMF7 | 多発性骨髄腫 |
| 放射性同位元素標識抗体 | イブリツモマブ(ゼヴァリン) | CD20 | 低悪性度B細胞非ホジキンリンパ腫、マントル細胞リンパ腫 |
遺伝子パネル検査とは
分子標的薬を使ったこれまでの治療では、遺伝子変異は1つひとつ調べられてきました。たとえば肺がんであれば、EGFRの変異を調べ、変異が見つからなければ、次の遺伝子変異を探すという方法です。しかし、最近になって、多くの遺伝子を一度に調べる検査が行われるようになってきました。2003年に、すべてのヒトゲノムの配列が解析され、研究レベルでは、人間のゲノム情報はかなり詳細に調べられるようになっていました。次世代シークエンサーという遺伝子の塩基配列を高速で読み出す遺伝子解析装置が登場したため、ゲノム解析は飛躍的に進歩し、それが普及することでコストもどんどん下がってきました。
技術的には人間のすべての遺伝子を調べることも可能です。しかし、実際にがんの治療に役立てることを考えると、現段階では、その方法は必ずしも効率がよいとはいえません。そこで、がんとの関係が明らかになっている遺伝子を選び出して一度に調べています。このような検査を遺伝子パネル検査といいます。
がんの遺伝子パネル検査は、国内外ですでにいくつかの種類が開発され、海外では実用化されているものもあります。
遺伝子パネル検査で調べる遺伝子の数は、少ないものでは数十の遺伝子ですが、多いものでは500遺伝子くらいのものもあります。遺伝子数が増えれば、それだけ得られる情報は多くなります。ただ、コストも膨らむため、検査費用は高くなります。
がんの遺伝子パネル検査の開発に関して、日本は欧米に比べて少し出遅れていました。たとえば米国では、2017年にFDA(米国食品医薬品局)が、がんの遺伝子パネル検査を承認しており、すでに多くの患者さんが検査を受けています。このまま日本での開発が進まなければ、海外の企業が参入して、日本のがんの患者さんは外国の遺伝子パネル検査を受けることになってしまいます。そうなると、検査費用が海外に流出するだけでなく、貴重な検査データも海外の企業に蓄積されていくことになります。そうした状況を回避するためには、日本で開発された遺伝子パネル検査の登場が待たれていました。
日本で開発された遺伝子パネル検査として最も早い時期に登場したのは、国立がん研究センターが開発した「NCCオンコパネル」です。これは114遺伝子のDNAを調べる遺伝子パネル検査で、2018年4月から先進医療Bとして実施されています。先進医療での患者負担額は46万4000円と報告されています (厚生労働省ホームページ: 第1回がんゲノム医療推進コンソーシアム運営会議(資料)平成30年8月1日より)。国内で最も早く先進医療Bとして行われており、早期の実用化も期待されています。
Todai OncoPanelの特徴
NCCオンコパネルより少し遅れ、2018年8月から先進医療Bとして実施されているのが、東京大学が開発したTodai OncoPanel(東大オンコパネル)です。この検査は、従来のがん遺伝子パネル検査にはない特徴をもっています(表2参照)。特徴の1つは、調べる遺伝子数の多さです。Todai OncoPanelで調べるのは464遺伝子のDNAです。先進医療Bもしくはわが国において薬事承認申請中のがん遺伝子パネル検査の中で、最も調べる遺伝子数が多くなっています(2018年11月現在)。
もう1つの大きな特徴は、RNAについても調べる点です。通常の遺伝子パネル検査では、遺伝子のDNAについて調べますが、Todai OncoPanelでは技術的に難しいとされていたRNAについても調べます。DNAパネル検査は464遺伝子が対象ですが、RNAパネル検査では463遺伝子(158遺伝子はDNAパネルと重複)を対象にしています。RNAパネル検査は、世界的にみても開発は進んでおらず、Todai OncoPanelの大きな特徴といえます。性能重視で開発され、得られる情報量が多いですが、RNAパネルを搭載している分の費用も要するため、Todai OncoPanelの先進医療での患者負担額は91万5000円となっています。
RNAパネル検査が加わると、融合遺伝子(染色体の転座、挿入、逆位などの組換えの結果、複数の遺伝子が連結されて生じる新たな遺伝子)の異常を検出できるというメリットがあります。がん細胞は遺伝子変異があることで発生しますが、変異が1つあるだけでは、がん化への影響が限定的なことが多いです。ところが、複数の遺伝子が連結し、融合遺伝子の形になると、単独でもがん化に大きな影響を及ぼしうることが知られています。そのような融合遺伝子が何種類か明らかになっていますが、こうした染色体の組換えを拾い上げるのに、RNAパネル検査が役立ちます。よく知られている融合遺伝子には、ALKやROS1があります。これらの融合遺伝子に関しては、それぞれを標的とした分子標的薬があり、非常によく効く症例が多いことが知られています。
融合遺伝子が原因となって発生するがんの頻度は、高いとはいえませんが、融合遺伝子の働きを阻害する分子標的薬を使うことで、大きな治療効果を得ることが期待されます。もともとがん遺伝子パネル検査は、がん種にとらわれず、頻度が低い遺伝子変異を含め、治療標的分子を漏らさずに拾い上げることが目的といえますので、融合遺伝子を確実に検出できるパネル検査の価値は非常に高いと考えています。例えば、肺がんや肉腫において融合遺伝子の検出率が高いことが、Todai OncoPanelでも明らかになっています。
DNAパネル検査では、RNAパネル検査より高い頻度で遺伝子変異が見つかりますが、いくつかの変異が重なることで、がんが発生している場合、単一な分子標的薬で十分な治療効果が得られないこともあります。野球にたとえると、遺伝子変異が蓄積していくタイプのがんは、長打力はないが、コツコツとヒットを打って高打率をマークするバッター(DNAパネルで複数の治療標的が見つかることがある)で、一方、融合遺伝子のように単独でがん化への影響が極めて大きいタイプのがんは、三振が多い(検出される頻度は低い)けれど、ときどき特大ホームランを打つ(著効する治療標的薬がみつかる)一発屋のバッターのようなイメージでしょうか。DNAパネルとRNAパネルの組み合わせが、Todai OncoPanelの最大の特徴といえます。
表2 Todai OncoPanelで対象となる遺伝子など
| DNAパネル | がん関連遺伝子(464) 塩基置換、欠失・挿入、コピー数変化など 融合遺伝子(17) ALK、BRAF、CD74、DNAJB1、EGFR、ETV6、EWSR1、FGFR2、FGFR3、NAB2、NTRK1、NUT、PAX8、RET、ROS1、TFE3、TMPRSS2 |
| RNAパネル | 融合遺伝子の検出 463遺伝子 肺腺がん融合遺伝子(67) 肉腫融合遺伝子(212) 公共データベースの融合遺伝子(370) |
| 重要な遺伝子の発現量比較※ がん関連遺伝子(125種類) BRCA1/2、MSH2/6、CD274(PD-L1)など | |
| 異形転写体の検出 MET、CTNNB1など |
(※遺伝子発現量は先進医療Bでは測定するが、返却対象とはしていない)
遺伝子パネル検査と免疫チェックポイント阻害薬
がんの分子標的治療に関しては、免疫チェックポイント阻害薬も注目されています。がん細胞はヒトの免疫から逃れる仕組みを獲得しているので、その仕組みが働かないような薬を使い本来の免疫の力を発揮させてがんを攻撃するのが、免疫チェックポイント阻害薬による治療です。大きな期待がかけられている治療ですが、実際に効果が得られるのは、患者さんの2割くらいであると言われています。どのような患者さんに効果があるのか、これまでは調べようがありませんでしたが、Todai OncoPanelでは、免疫チェックポイント阻害薬の効果が期待できるかどうかにも着目しています。
その判定に必要となる情報は、遺伝子変異数の多さです。遺伝子変異の数が極端に多い状態をハイパーミューテーション(高頻度遺伝子変異:hypermutation、またはTumor Mutation Burden-High)と言いますが、これは多くの場合、ミスマッチ修復遺伝子などのDNA修復に関わる遺伝子の異常によって起こります。ミスマッチ修復遺伝子とは、DNAに変異が起きたときに、すぐにそのミスを修復してくれる遺伝子のことです。この遺伝子に異常があると、DNAに起こったミスをそのままにしてしまいます。それによってハイパーミューテーションの状態になり、がんが発生しやすくなるのです。
ミスマッチ修復遺伝子に異常をもつがんには、免疫チェックポイント阻害薬がよく効く可能性があります。遺伝子変異がたくさんあるがんでは、がん細胞だけがもつ抗原(異物:ネオ抗原)がたくさん発現しているため、異物を排除する免疫の力がもともと発揮されやすいのです。ところが、がん細胞は免疫を逃れる仕組みを使い、免疫が働かないようにしています。このようながんに免疫チェックポイント阻害薬を使用すると、免疫から逃れる仕組みが解除されて免疫の力が一気に発揮され、がん細胞を攻撃するようになるのです。
したがって、免疫チェックポイント阻害薬が効きやすいかどうかは、遺伝子変異の数が多いかどうかが参考になります。Todai OncoPanelの場合、DNAパネル検査で464遺伝子を対象としているため、検出される遺伝子数も多くなります。例えば、20~30以上の遺伝子変異が見つかれば(正確には100万塩基対あたり10遺伝子以上)、遺伝子変異が多い状況であると判断します。一般に調べる遺伝子の数が少ないほど、このような判定を行うのは難しくなります。
米国では、ミスマッチ修復遺伝子に変異がある(もしくはマイクロサテライト不安定性の)固形がんに対しては、がん種にかかわらず、免疫チェックポイント阻害薬のペムブロリズマブ(製品名:キイトルーダ)を使用することができます(2017年5月にFDA承認)。
遺伝子パネル検査法と流れ
遺伝子パネル検査がどのように行われるか、Todai OncoPanelを例にとって説明しましょう(図1参照)。
がん細胞の遺伝子を調べるために必要となるのは、がんの組織と患者さんの血液です。がんの組織は、すでに行った手術や検査で採取したものを使用するため、遺伝子パネル検査のために組織を採取する必要はありません。血液を採取するのは、がん細胞の遺伝子情報と正常細胞の遺伝子情報を比較することで、がん細胞のどこに変異が起きているのかを見つけ出すためです。また、正常細胞において、遺伝性腫瘍にかかわる遺伝子に変異(生殖細胞系列変異)が同定される場合があります。
遺伝子パネル検査の解析結果は、複数の領域の専門家で構成されるエキスパートパネルで検討され、どのような意義があるかの検討が行われます。それをレポートにまとめ、担当医が患者さんに説明を行います。
遺伝子パネル検査を受けると、自分のがんの治療に最適の分子標的薬が見つかる可能性があります。特定の遺伝子変異が見つかり、それを標的とする分子標的薬が存在する場合です。その薬が国内で承認されていて、保険で使うことができる薬なら申し分ないでしょう。
自分のがんを治療するのに最適の分子標的薬が、たとえ承認されていなかったとしても、その薬の治験が進行中で、治験に加わる要件を満たしていれば、その薬による治療を受けることが期待できます。また、最適の薬が国内未承認の薬で、海外で承認されている場合、または、国内保険適用の対象がん種でなく適応外使用となる場合、現時点では自費による治療以外は難しいですが、近い将来わが国でも保険適用になる(または対象がん種の適応が拡大される)場合もあります。
一方で、遺伝子パネル検査を受けても、治療選択につながる情報が得られないこともあります。がんの原因と考えられる遺伝子変異が見つからない、もしくは遺伝子変異が見つかってもその変異を標的とする分子標的薬が存在しない場合です。また、見つかった遺伝子変異を標的とする薬はあるが、海外でしか治験が行われていない場合、通常その治験に加わることはできないので、やはり治療選択には直結しません。実際、遺伝子パネル検査を受けても、結果的に治療選択に役立つ情報を得られないことも多くあります。
Todai OncoPanelでは、解析結果を、Tier1、Tier2、Tier3、Tier4、Tier5、TierRの6段階に分類しています(図2参照)。このうち、Tier1、Tier2、TierRに分類される遺伝子変異や、ハイパーミューテーションであることがわかった場合には、治療選択に役立つ情報が得られることになります。先進医療として実施される前のデータでは、Todai OncoPanelを受けた人で、上に示したような治療選択に役立つ情報が得られた人の割合は約33%でした。
このように、遺伝子パネル検査を受けても、必ずしも治療選択に役立つ情報が得られるわけではありません。この検査を受ける場合には、この点をよく理解しておく必要があります。
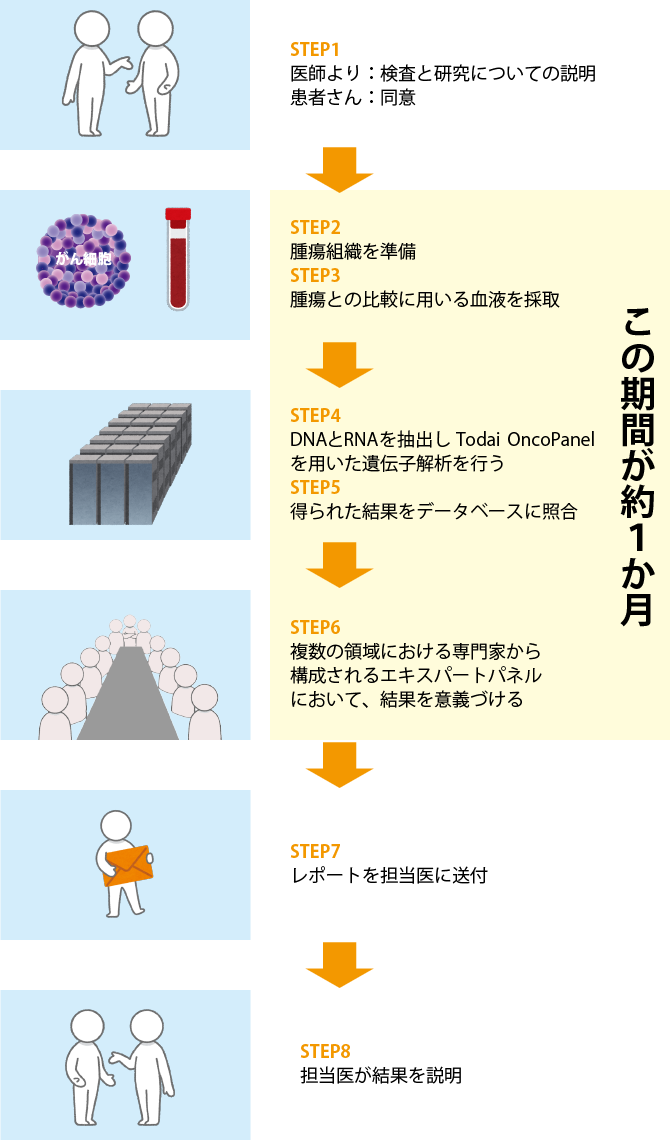
図2 エビデンスレベル分類 Todai OncoPanelにおけるエビデンスレベル分類
| Tier1 | 国内保険承認薬の標的とする変異 |
| Tier2 | 国内治験薬とFDA承認薬の標的とする変異 |
| Tier3 | 知識データベース上に登録のある薬剤感受性変異 |
| Tier4 | 論文に報告のあるがん関連変異 |
| Tier5 | 知識データベースに高頻度に報告のある変異 |
| TierR | 知識データベース上に登録のある薬剤耐性変異 |
三学会合同エビデンスレベル分類(日本臨床腫瘍学会・日本癌治療学会・日本癌学会合同)
| 治療効果判定 | エビデンスレベル分類 |
|---|---|
| 1A | 当該がん種においてコンパニオン診断薬として薬事承認されたバイオマーカー(遺伝子異常) |
| 1B | 当該がん種においてコンパニオン診断薬(もしくはコンプリメンタリー診断薬)としてFDAで認証されたバイオマーカー(遺伝子異常) |
| 当該がん種においてバイオマーカーによる患者選択を行う前向き臨床試験もしくはメタ解析データにより、抗がん薬の臨床的有用性に対する一貫性のある結果が得られているバイオマーカー(遺伝子異常) | |
| 2A | 当該がん種において前向き臨床試験のサブグループ解析により抗がん薬の臨床的有用性を示す結果が得られているバイオマーカー(遺伝子異常) |
| 2B | 異なるがん種において薬事承認されている、もしくは抗がん薬の臨床的有用性を示す結果が得られているバイオマーカー(遺伝子異常) |
| 3A | 科学的知見に基づく症例報告等により抗がん薬の臨床的有用性との関連が報告されているバイオマーカー(遺伝子異常) |
| 3B | In vitro及びin vivoでの薬力学的評価により抗がん薬の治療効果との関連が報告されているバイオマーカー(遺伝子異常) |
| 4 | がんに関与することが知られている遺伝子異常 |
Todai OncoPanel先進医療Bから薬事承認へ
Todai OncoPanelは、2018年10月から先進医療Bとして、東京大学医学部附属病院と連携する16の病院で実施されています。先進医療ですから、Todai OncoPanelの費用である91万5000円は患者さんが自己負担しますが、通常の治療と共通する診察・検査・投薬・入院などの費用は保険の対象となります。
行われる研究の題名は、「Todai OncoPanelの開発に関わる臨床性能試験(がんゲノム医療の有効性検証のための基礎研究)」となっています。予定試験期間は1年半で、予定症例数は200例です。
先進医療Bとして行われるTodai OncoPanelの対象となるのは、表に示した適格条件を満たしている患者さんです(表3参照)。
この臨床研究は、Todai OncoPanelを受けることで治療選択に役立つ情報が得られた患者さんがどれくらいいたか、その頻度を調べることを目的としています。治療選択に役立つ情報が得られたとされるのは、次のような患者さんです。
(1)Tier分類によりTier1、Tier2、TierRに分類される遺伝子異常がある、並びにハイパーミューテーション(総体細胞変異頻度が基準値を超えるもの)がある。
(2)病理学的診断の補助となる遺伝子変異(融合遺伝子等)がある。
こういった臨床性能試験を行い、Todai OncoPanelが、がんゲノム医療に役立つ有用性の高い検査であるかどうかを検証していくわけです。
200例の検査を実施し、そのデータがまとまったところで、薬事申請を行う予定です。臨床性能を担保する結果が得られて薬事承認が下り、保険収載され、多くの患者さんが保険でこの検査を受けられるようになることを目指しています。
表3 先進医療Bの適格条件
| 1 | 病理学的診断によって、悪性腫瘍であることが診断されている(がん腫、肉腫、いずれも含むが血液腫瘍を除く) |
| 2 | 治癒切除不能、または、再発により標準治療による根治が困難と考えられる |
| 3 | 標準治療がない、標準治療終了後、もしくは標準治療終了見込みである |
| 4 | パネル検査の実施によって次の治療選択に関して利益があると考えられる患者 |
| 5 | Performance Status(PS)が0、または1である |
| 6 | 評価可能な量のがんを含む病理標本があり、正常細胞として末梢血の採決が可能な症例 |
| 7 | 本研究の参加について患者本人から文書でインフォームド・コンセントが得られている(20歳未満の場合は、法的に認められる代諾者の同意を必要とする) |
遺伝子パネル検査が導くがん医療の進歩
Todai OncoPanelのような遺伝子パネル検査の有用性は、新たな分子標的薬が開発されたり、従来からある分子標的薬の適応範囲が拡大されたりすることで、現在よりもさらに高まっていくと考えられます。たとえ遺伝子変異が見つかっても、それを標的とする薬がなければ治療につながりませんが、その遺伝子変異を標的とする薬が新たに開発されれば、その遺伝子変異は治療選択に役立つ遺伝子情報となるからです。そのためにも、分子標的薬の開発や適応拡大が進むことが期待されています。
また、Todai OncoPanelのような遺伝子パネル検査で得られたデータは、1人ひとりの患者さんの治療選択に役立つだけでなく、集積されることでがん医療の進歩に貢献すると考えられています。
現在、行政面でもがんゲノム医療の推進が図られており、2018年6月1日には国立研究開発法人国立がん研究センター内に「がんゲノム情報管理センター(C-CAT=Center for Cancer Genomics and Advanced Center)」が開設されました。ここでは全国のがんゲノム医療のデータを、個人情報保護に留意したうえで集約・管理し、そのデータを新たな医療の創出のために適切に利活用していくとしています。そして、このような体制を作り上げるため、「がんゲノム医療中核拠点病院(11施設)」と「がんゲノム医療連携病院(2018年10月1日時点136施設)」を指定しています。全国で行われたがんゲノム医療の情報を、集約し管理する体制が整ってきたわけです。
このようにデータが集まってビッグデータが構築されると、日本人のがん遺伝子変異に見られる特徴が明らかになる可能性があります。また、日本人に特有の副作用に関するゲノム情報が集まるかもしれません。そうしたデータは、新たな薬を開発していくうえでも、個々の患者さんに適切な薬剤を適切に届けていく体制を目指していくうえでも、非常に重要なものになるでしょう。集められたデータは、まさに国の宝なのです。
がんゲノム医療にかかわる膨大なデータを、国が主導してC-CATのような1つのデータセンターに集めるのはとても有益です。Todai OncoPanelなどの遺伝子パネル検査が保険で受けられるようになり、国民皆保険という枠組みのなかでビッグデータが構築され、将来のがん医療の発展につながることが切に望まれます。
プロフィール
織田克利(おだ・かつとし)
2005年 東京大学医学部附属病院助手
2007年 東京大学医学部附属病院助教
2012年 東京大学医学部附属病院講師
2013年 東京大学大学院医学系研究科産婦人科学講座生殖腫瘍学准教授

