膵臓がんに対するS-1併用化学放射線療法+ニボルマブの治験
治験の募集状況は、「jRCT 臨床研究等提出・公開システム![]() 」ページでご確認ください。
」ページでご確認ください。
治験名
PENETRATE
膵がん患者を対象としたS-1併用化学放射線療法+ニボルマブの第3相試験(医師主導治験)
治験概要:
膵臓がんに対する治験。未治療の患者さんが対象です。
ニボルマブ+S-1併用化学放射線療法とS-1併用化学放射線療法を比較して、有効性と安全性で評価する臨床試験です。
登録予定数は、216人。
フェーズは、第3相臨床試験。
試験デザインは、非盲検ランダム化比較試験。
試験群:ニボルマブ+S-1併用化学放射線療法
対照群:S-1併用化学放射線療法
全生存期間、無増悪生存期間、奏効割合、有害事象発生割合、重篤な有害事象発生割合などで評価します。
疾患解説:膵臓がん
疾患の詳細は、「膵臓がんを知る」を参照ください。
治験薬:ニボルマブ
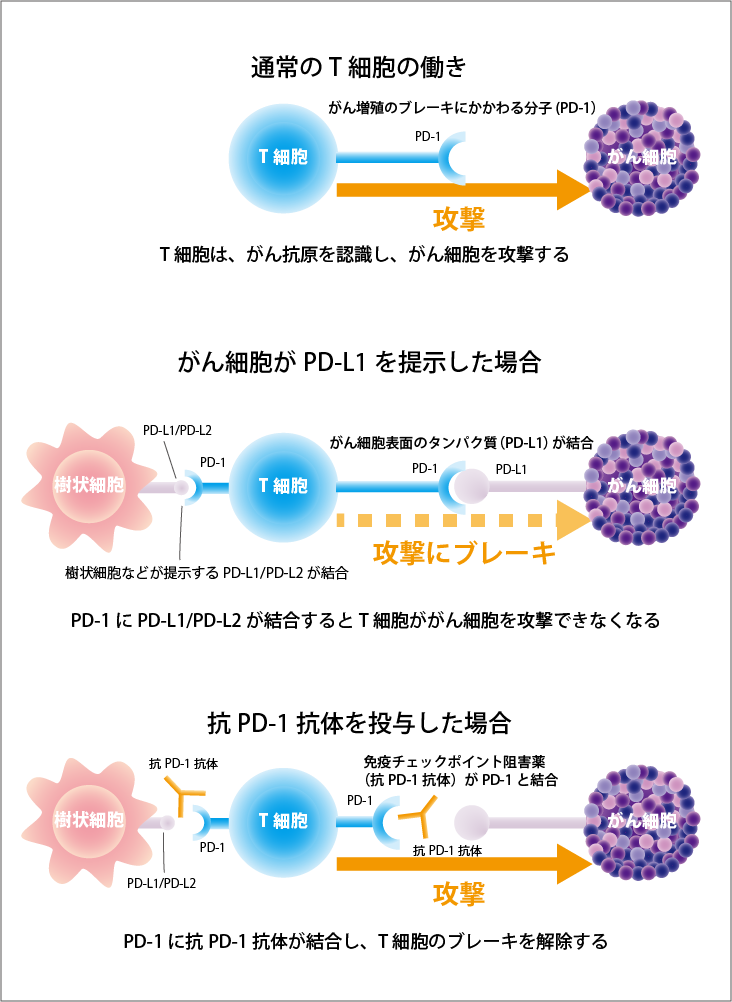
ニボルマブは、抗PD-1抗体という免疫チェックポイント阻害薬の1つです。
免疫チェックポイント阻害薬は、がんに対して、免疫細胞が本来の力を発揮できるようにする薬です。最終的には、免疫の力でがんを攻撃し、治療効果を発揮します。
がん細胞の表面に発現しているPD-L1とがん細胞を攻撃する免疫細胞(T細胞)に発現しているPD-1が結合すると、免疫細胞は、がん細胞を攻撃しなくなってしまいます。この仕組みを「免疫チェックポイント機構」といい、この仕組みが働かないように開発されたのが、免疫チェックポイント阻害薬です。
治験薬: S-1
S-1は、DNAを構成するピリミジン塩基という成分と同じ構造をもつ成分に変換される薬が配合された代謝拮抗薬(ピリミジン拮抗薬)です。テガフール、ギメラシル、オテラシルカリウムの3つの配合剤です。
テガフールは、体内で徐々にDNA合成やRNA機能障害を起こすフルオロウラシルに変換され細胞死に至らす作用があります。ギメラシルは、フルオロウラシルを分解する酵素を阻害しフルオロウラシルの血中濃度を維持させます。オテラシルカリウムは、消化管粘膜障害を軽減する作用があります。
治験薬:ゲムシタビン
ゲムシタビンは、細胞の増殖に必要なDNA合成を阻害する代謝拮抗薬(ピリミジン拮抗薬)と呼ばれる抗がん剤です。
細胞増殖に必要なピリミジン塩基という物質が必要で、DNAが合成されるときピリミジン塩基と似た構造のピリミジン拮抗薬が代わりに取り込まれることで抗腫瘍効果を発揮します。
ピリミジン系抗がん剤には、ゲムシタビンのほか、フルオロウラシル、テガフール・ギメラシル・オテラシルカリウム配合剤、シタラビン、カペシタビンなどがあります。
ゲムシタビンは、細胞内で代謝され、DNA合成を直接的、間接的に阻害します。
治験情報に関する注意点
治験は、治療を兼ねた臨床試験のことです。薬の元となる物質を動物実験などで有効性や安全性を確認した上で、ヒトに対して使用しても同様に安全で治療効果が予測されるもので行われますが、治験の時点ではまだ有効性や安全性が十分に確認できているわけではありません。有効性や安全性が科学的に証明された治療が、標準治療で、新しい治療が必ずしも最良の治療ではないということを理解してください。その一方で標準治療が確立していない、または薬の耐性ができ、効果が期待できる薬がなくなった患者さんにとって治験は新しい治療選択となる可能性もあります。
治験は「ヘルシンキ宣言」に基づく倫理的原則と、「医薬品の臨床試験の実施に関する基準(GCP)」を遵守して行われています。これにより、治験に参加される方の利益が損なわれることがないよう、安全な手続きで治験は進められます。
治験情報を探すとき、治験を受けたいと思ったときは、まず治験とはどのようなものなのかを理解してください。
がんの治験情報をお探しの方に知ってほしい5つのこと
※ここに掲載した情報は、jRCT 臨床研究等提出・公開システム に登録された情報を元にし、がんプラスが独自に記事としてまとめ、提供しています。
※QLife「がん治験情報サービス」でご案内している治験とは異なります。
試験概要詳細
| 試験の名称 | 膵癌患者を対象としたS-1併用化学放射線療法+ニボルマブの第III相試験(医師主導治験) |
| 試験の概要 | 膵癌患者を対象とし、S-1併用化学放射線療法にニボルマブを併用することの優越性を非盲検ランダム化比較第III相医師主導治験において検証する |
| 疾患名 | 膵癌 |
| 試験薬剤名 | ニボルマブ |
| 用法・用量 | S-1併用化学放射線療法中:day1及びday29に、ニボルマブ480mg/bodyの投与を行う 追加化学療法中:GEMと併用してニボルマブ480mg/bodyを4週毎に1年間投与を行う |
| 対照薬剤名 | |
| 用法・用量 | |
| 試験のフェーズ | フェーズ3/phase3 |
| 試験のデザイン | 非盲検ランダム化比較試験 |
| 目標症例数 | 216 |
| 適格基準 |
|
| 除外基準 |
|
| 主要な評価項目 | 有効性/efficacy |
| 主要な評価方法 | 全生存期間 |
| 副次的な評価項目 | 有効性/efficacy |
| 副次的な評価方法 | 無増悪生存期間、奏効割合等 |
| 副次的な評価項目 | 安全性/safety |
| 副次的な評価方法 | 有害事象発生割合、重篤な有害事象発生割合等 |
| 予定試験期間 | 2020年10月1日~2028年1月31日 |
出典:臨床研究等提出・公開システムより

