免疫チェックポイント阻害薬の正体─がんに効くしくみと治療

2018.11 取材・文:町口充
2018年のノーベル医学生理学賞は、京都大学の本庶佑特別教授と米国テキサス大学のジェームス・アリソン教授が受賞しました。2人は、体の免疫機構にブレーキをかけるしくみががんを攻撃する免疫応答を抑制していることを発見し、このブレーキを解除することでがん治療の効果を上げる新たな免疫療法を実現しました。これまでのがん治療は、外科療法、化学療法、放射線療法による、がんそのものを標的とするものでしたが、「がん免疫療法」は、患者さん自身の免疫系を活用することによって体内のがん細胞を攻撃します。従来とは異なる治療アプローチとして登場した「免疫チェックポイント阻害薬」は、すでに6つの薬剤が保険承認を得てがん治療に使われており、治療対象をさまざまながん種に広げた臨床試験も数多く行われています。今回は、免疫チェックポイント阻害薬の基本と治療について、今後の動向と併せて紹介します。
免疫のしくみ―自然免疫と獲得免疫
私たちの体に備わっている「免疫」とは、自分の体である「自己」と自分ではない「非自己」を識別し、非自己を排除するしくみのことです。非自己にあたるのは、体の外から侵入してくるウイルスや細菌などの病原体や、体内で発生した異常細胞などの異物です。
免疫を担当する細胞は、体の中を常時パトロールしていて、異物を見つけると排除すべく、すぐに動き出します。このしくみを「自然免疫」といい、マクロファージやNK細胞、樹状細胞などが担当しています。
免疫系には、もう1つ「獲得免疫」があります。獲得免疫は、体内で一度見つけられた異物に対して、すぐに強力な攻撃できるよう備えるしくみで、主にT細胞やB細胞などのリンパ球が担当します。異物の情報は、自然免疫から獲得免疫に伝えられ、獲得免疫は自然免疫からの情報にもとづいて、免疫を担当する細胞の数を一気に増やして攻撃します。
異物の情報を獲得免疫に伝える重要な役割を果たすのが、樹状細胞です。樹状細胞は、病原体やがんなどの異物の目印である「抗原」というタンパク質の情報をT細胞に伝えて反応させます。それによりT細胞は、一気に増えてキラーT細胞となって異物を攻撃、排除攻撃するとともに、メモリー細胞となって再び同じ異物が現れたときに即座に反応できるように備えます。
がんと免疫の関係
私たちの体の中で発生するがん細胞も、遺伝子の異常(異常なタンパク質を持つ)によって発生した異常細胞です。このためかつては、免疫はがん細胞を異物として排除し生体を防御しているという「がん免疫監視説」の概念が提唱されていました。しかしそれなら、がん細胞が発生しても免疫機構による監視と排除によって、病気になる前に防げているはずです。実際にはがん細胞は無限の増殖を続け、人の命を奪うまでになっています。これは、「がん免疫監視説」では説明がつきません。
そこで最近、広く認められるようになっているのが「がん免疫編集説」という概念です。がん細胞は成長過程において巧みに免疫から逃れるしくみを獲得していくというもので、「がん免疫監視説」をさらに発展させた考え方です。
がんと免疫の関係は、「排除相」「平衡相」「逃避相」とよばれる3相を段階的に進みます。
最初は排除相です。がん細胞が遺伝子の変異細胞として生体内で発生すると、異物としての性格が強いため免疫は即座に異物と判断し、免疫担当細胞が攻撃して排除します。私たちの体の中では毎日3000個におよぶがん細胞が生じているといわれますが、この時点では免疫ががんの発症を未然に防いでいます。
しかし、がん細胞も生き残るために必死になって“知恵”を絞ります。免疫細胞からの攻撃にさらされないよう異物としての性格を弱めようとするのです。たとえば、T細胞が異物を攻撃する際には、細胞表面にあるMHC(主要組織適合遺伝子複合体:major histocompatibility complex)という分子が提示した抗原を認識して攻撃を仕掛けます。このとき、がんは自身のMHC分子を消失させることによって異物であることを隠したり、抗原としての性格の強い異常なタンパク質を隠したりして免疫からの攻撃を逃れます。がん細胞は増大せずに免疫と平衡状態にあるため、この段階は平衡相とよばれます。
がん細胞が勢力を広げるために次に取る作戦が、免疫の制御です。私たちの体には、過剰な免疫反応を抑えることで生体の恒常性維持のために働く制御性T細胞(Treg: regulatory T cell)などの免疫抑制細胞や、免疫チェックポイント分子が存在しています。がん細胞はこのしくみを積極的に利用して免疫の攻撃を回避することで増殖していきます。がん細胞が免疫から逃れるようになった逃避相とよばれる段階です。
これを実際の臨床でみてみると、検査などで病気を疑われがんと診断されるのは、まさにがん細胞が増殖しているときです。つまり、排除相と平衡相を過ぎて、がん細胞が免疫にブレーキをかけるなどの手段を獲得して自由に増殖できるようになった逃避相の段階にあるといえます。
免疫チェックポイントとは
2018年のノーベル医学生理学賞に輝いた京都大学の本庶佑特別教授と米国テキサス大学のジェームス・アリソン教授によるそれぞれの研究は、それまでの免疫療法の中心だった免疫を活性化させる方法とは逆の、免疫の働きを抑える分子のがん免疫への関わりと治療への応用を契機にしています。
従来、がんの免疫療法といえば、インターフェロンα(IFN-α)やインターロイキン2(IL-2)といったサイトカイン療法やがんワクチンに代表される免疫を増強してがんを直接攻撃する、車でいえばアクセルを踏んでスピードを上げるような方法でしたが、効果は一部の患者にとどまるのみでした。
これに対して、本庶教授とアリソン教授は、体の中で働く免疫機構にブレーキをかけるしくみががん免疫に関わっていることを発見しました。免疫チェックポイント分子は、免疫応答を制御する分子です。自己を攻撃しないためや過剰に活性化しないためにT細胞を抑制します。このブレーキを解除する薬剤を新たに作り、がんを攻撃する新たな治療法を実現したのです。
この方法は、まさに巧妙な戦略で逃避相に達したがんを狙い撃ちにするものであり、進行したがんであっても劇的な治療効果を発揮することが明らかになっています。
免疫チェックポイント分子PD-1、CTLA-4の発見
両教授の研究は、それぞれ独自に始められました。
本庶教授らの研究チームが目指していたのは、T細胞に生じるアポトーシス(細胞死)の解明です。獲得免疫のT細胞は、異物排除の役割を終えると抗原情報を記憶する細胞だけを残し、アポトーシスによって自ら消滅します。どのようにしてT細胞にアポトーシスが生じるかを知るため、アポトーシスが生じる際に発現してくる遺伝子の探索を行っていました。そして1992年に発見したのが活性化したT細胞に発現するPD-1 (programmed cell death-1:プログラム細胞死タンパク質1)遺伝子です。PD-1のPDは「細胞のプログラム死」を意味しています。
一方、アリソン教授らは1987 年にフランスの研究チームががんを認識するT細胞の活性化にかかわる物質として発見したCTLA-4(細胞殺傷性Tリンパ球抗原4)について調べ、この分子がT細胞によるがん細胞への攻撃にブレーキをかける働きをもっていることを1995年に突き止めました。さらにCTLA-4の働きを抑えればT細胞にかかっているブレーキが外れてがんを攻撃できると考え、1996年、がん細胞を移植したマウスにCTLA-4をブロックする抗体を投与して、がん細胞の消失や退縮をもたらす効果があることを実証しました。2011年には、この抗体を用いた世界初の免疫チェックポイント阻害薬(ICI:immune checkpoint inhibitor)「イピリムマブ(製品名:ヤーボイ)」が米国で承認されています。
これに対して本庶教授らは、PD-1ががん細胞の表面にあるPD-L1という刺激分子と結合するとT細胞の機能が抑制されることを明らかにし、PD-1をブロックする研究に着手しました。2014年、PD-1をブロックする抗体を用いた免疫チェックポイント阻害薬である「ニボルマブ(製品名:オプジーボ)」は世界に先駆けて日本で承認されたのです。
なお、PD-1と結合してT細胞の働きを抑える刺激分子には、PD-L1のほかにPD-L2が発見され、それぞれ役割が異なることがわかっています。
免疫チェックポイント分子PD-1とCTLA-4の違い
PD-1とCTLA-4はともに、異物を排除するT細胞を抑制する免疫チェックポイント分子として機能していますが、作用するメカニズムには違いがあります。
T細胞に発現するPD-1に結合してシグナルを伝える分子であるPD-L1 とPD-L2はがん細胞表面に直接発現するので、両者の結合をブロックすればがん細胞を攻撃することができます。またPD-L1およびPD-L2は樹状細胞などの抗原提示細胞にも発現しているので、T細胞が抗原を認識して活性化する際にも両者の結合をブロックすれば、T細胞の活性化は促進されます(図1参照)。
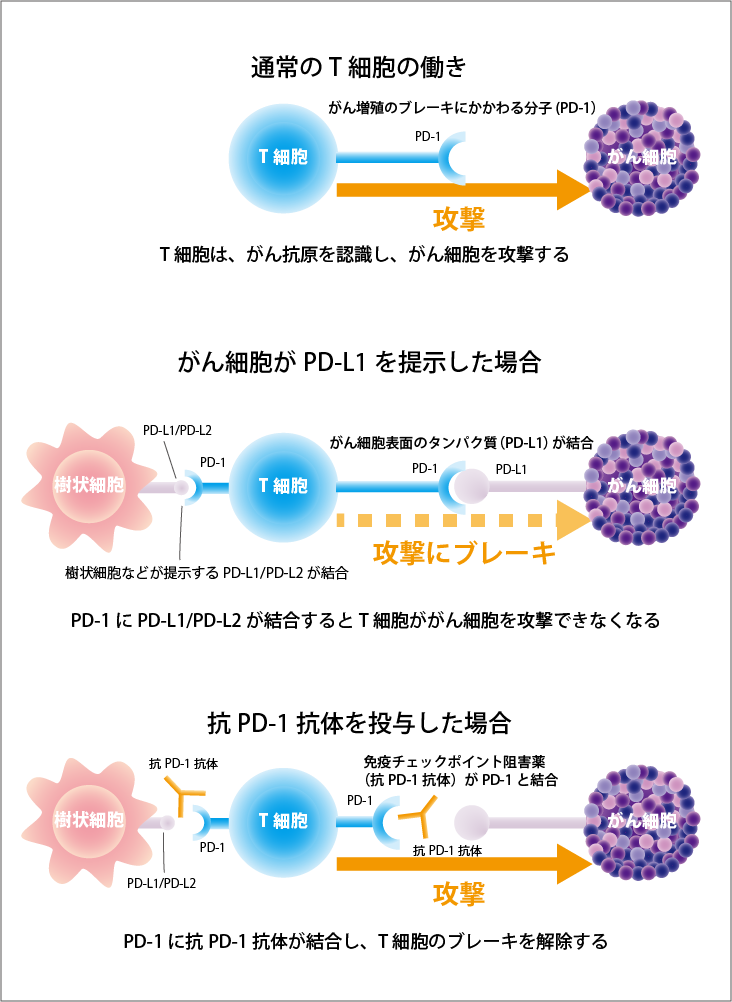
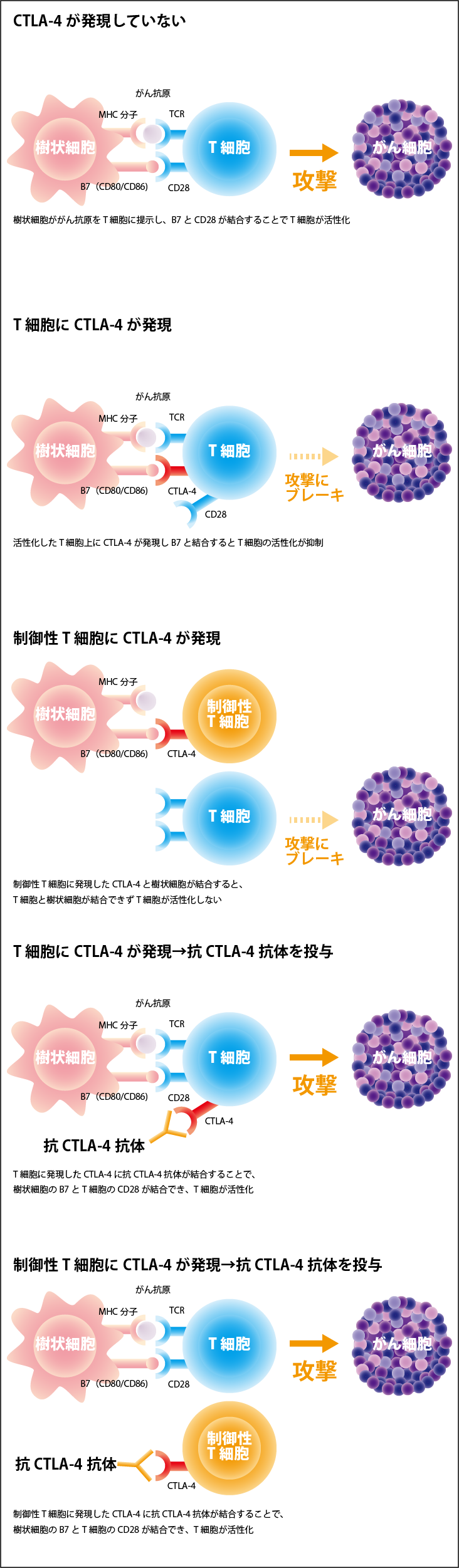
一方、T細胞表面に発現するCTLA-4は、この刺激分子であるB7(CD80/CD86)と結合することによって、異物を排除するT細胞の働きにブレーキをかけます。CTLA-4は免疫細胞、とりわけエフェクターT細胞に発現していて、CTLA-4がB7(CD80/CD86)と結合すると、エフェクターT細胞の活性化が抑制されます。また、CTLA-4は免疫抑制機能を有する制御性T細胞上には恒常的に発現しているので、がん細胞はこれも利用してT細胞の働きにブレーキをかけています。
そのため、CTLA-4がB7(CD80/CD86)と結合するのをブロックすれば、T細胞にかかっているブレーキを解除して活性化させることでがん細胞を攻撃できます(図2参照)。
現在、日本国内で承認済みまたは申請中の免疫チェックポイント阻害薬は、PD-1、PD-L1、CTLA-4と結合して効果を発揮するものです。最新の承認と申請状況は、「免疫チェックポイント阻害薬開発状況」をご参照ください。
新たな免疫チェックポイント分子の研究
これらのほかにも、免疫抑制細胞にブレーキをかけてがんを攻撃する抗体薬が現在、さまざまな制御分子や刺激分子についての治験が行われています。
たとえば、国立がん研究センターで取り組まれているのが、CCR4という免疫細胞上に発現しているケモカイン受容体(chemokines receptors)を標的として制御性T細胞を除去する新規のがん免疫療法の開発です。一部の制御性T細胞上にはCCR4が選択的に発現しており、がん細胞はこれを利用して増殖していることが考えられます。そこで抗CCR4抗体によってCCR4陽性細胞を除去することで活性化した制御性T細胞を除去し、がんに対する免疫活性を増加させるのが狙いです。
実は、抗CCR4抗体はすでに成人T細胞白血病リンパ腫(ATLL:adult T-cell leukemia-lymphoma)を治療する世界初の抗体医薬品「モガムリズマブ(製品名:ポテリジオ)」として承認されており、治験は、この薬を制御性T細胞除去薬として適応を広げる研究です。2013年から国内6施設で進行・再発の固形がんを対象に、安全性と除去効果を検討する第1相臨床試験が行われています。
ほかにも、T細胞や制御性T細胞の働きにブレーキをかける免疫チェックポイント分子としてLAG-3があり、このLAG-3を阻害することによりがん抑制効果が得られるのではないかと研究・開発が進んでいます。
また、すでに承認済みの抗PD-1抗体、抗PD-L1抗体、抗CILA-4抗体の適応拡大が検討されていて、さまざまながん種について臨床試験が行われています。最新の臨床試験状況は、「免疫チェックポイント阻害薬開発状況」をご参照ください。
免疫チェックポイント阻害薬の効果
免疫チェックポイント阻害薬の作用や効果の現われ方には、従来の殺細胞性の抗がん薬とはまったく異なる特徴があります。それは、免疫チェックポイント阻害薬が有効だった患者さんでは長期生存が可能になるということです。
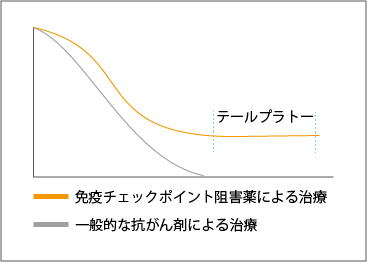
抗がん薬の効果を示すとき、カプラン-マイヤー曲線と呼ばれる生存曲線がよく用いられます。生存割合が時間の経過によって変化する様子を示すものですが、殺細胞性抗がん剤を用いたときは、多くの場合で時間の経過とともに曲線は下降していきます。ところが、免疫チェックポイント阻害薬による治療では、下降することなく途中からほぼ水平に伸び続けるのです(図3参照)。この現象を「テールプラトー」と呼びますが、免疫チェックポイント阻害薬が効いた患者さんが長期生存していることを示しています。
たとえば、進行した悪性黒色腫(メラノーマ)で抗CTLA-4抗体イピリムマブの投与を受けた患者さんの場合、10年を超えた生存が20%に達しています。全身にメラノーマが広がった患者さんがイピリムマブの単剤投与で10年以上の余命が得られるというのは、ほぼ治癒したに等しく、従来の薬物療法では考えられないことです。
また、投与回数が少なくてすむのも特徴で、イピリムマブでは、体重1kgあたり3mgを3週間の間隔をあけて4回点滴注射すると治療は終わります。進行メラノーマでイピリムマブの投与を受けた患者さんの2割は、4回の注射だけで10年以上生きているということです。投与された抗体が体の中の免疫を活性化させるため、免疫反応がしっかり働き、治療効果が持続すると考えられています。
免疫チェックポイント阻害薬の注意点
免疫チェックポイント阻害薬は、残念ながら、すべての患者さんに有効ではなく、効果が出るのは2割ぐらいの患者さんに限られています。どのがん種でも同様の傾向にあります。つまり単剤の場合、8割の患者さんでは効果が認められません。
その理由として考えられるのは、患者さん個々でがんの特徴が違うということです。たとえば、PD-1に結合する分子はPD-L1とPD-L2がありますが、それぞれ違った働きをしています。患者さんによって、PD-L1が強く働く人、逆にPD-L2が強く働く人など違いがあり、その違いに応じた薬の使い分けも重要になります。
さらに、最近わかってきたこととして、免疫チェックポイント阻害薬の治療を受けた患者さんの1割弱では、腫瘍が急速に増大して病気が悪化する「ハイパー・プログレッション・ディズィーズ(Hyper Progressive Disease:HPD)」といわれる現象が起こることがあります。なぜHPDが起こるのか、その原因は今のところ不明です。治療を契機として病気が進行するので、十分な注意が必要となります。
この現象はどのがん種でも起こり、抗PD-1抗体薬を用いたときに主にあらわれますが、抗CTLA-4抗体薬ではそれほど報告されていません。
これらの点から、免疫チェックポイント阻害薬による治療に際しては、各々の患者さんのがんの特徴を調べて、どの薬が最も適しているかを十分に考慮したうえで治療することがいかに大事かがわかります。そのためには治療に対する反応性を予測するバイオマーカーを見つけることが急務となっており、現在、研究が進んでいるところです。
免疫チェックポイント阻害薬の有害事象と対策
有害事象は、従来の化学療法に比べると頻度が少なく、現れたとしても軽いものが多いという報告があります。ただし、従来の殺細胞性の抗がん薬とは異なる作用メカニズムをもつため、当然、有害事象も違った現われ方をし、免疫チェックポイント阻害薬に特化した対応が必要です。
免疫チェックポイント阻害薬の有害事象は、免疫にかかっているブレーキを免疫チェックポイント阻害薬が解除し免疫反応が過剰になるために起こります。そのため、自己免疫疾患に類似した症状を呈することが多く、免疫関連有害事象(irAE:immune‐related adverse event)と呼ばれます。
免疫チェックポイント阻害薬による免疫関連有害事象では、皮膚や消化器系、内分泌系、神経系など、全身のあらゆる臓器に炎症性の免疫反応があらわれることが報告されています。免疫チェックポイント阻害薬による免疫関連有害事象の中でも重大なものには次のようなものがあります。
- 間質性肺障害
- 大腸炎、消化管穿孔
- 心筋炎、心不全
- 劇症型1型糖尿病
- アナフィラキシー性ショック
- 重度の皮膚障害
- 血小板減少症
- 脳炎・脳症
- ギランバレー症候群
- 急性副不全
- 腎炎・急性腎不全
従来の殺細胞性抗がん薬の場合だと投薬を中止すれば改善するのが一般的ですが、免疫関連有害事象は投薬を中止しても続くことが多いとの報告があり、その点でも注意が必要です。
免疫関連有害事象の重症化を防ぐには、できるだけ早期に有害事象の出現を見つけて迅速に対処することが肝心です。患者さん本人はもちろん、家族の方も、免疫チェックポイント阻害薬の治療を始める前から有害事象について十分に理解しておくことが大事となります。
免疫チェックポイント阻害薬の治療にあたっては必要に応じて各疾患の専門医との連携も欠かせません。このため名古屋大学医学部附属病院などでは、免疫チェックポイント阻害薬の治療を開始する前に患者さんに必ず内分泌内科を受診してもらうことになっており、各分野の専門医と連携して副作用対策のためのチーム医療にも力が入れられています。患者さんの側からすれば、こうしたチーム医療がしっかりと確立しているかどうかを確かめたうえで、最適な治療を選択する必要があるといえるでしょう。
免疫チェックポイント阻害薬特有の治療経過
一見すると悪化のような現象が、実は抗腫瘍効果の現われによる場合があり、その点は免疫療法の特徴であるともいえます。
シュード・プログレッション(擬性進行)と呼ばれるもので、免疫細胞ががんを攻撃していると腫瘍部分が大きくなって、がんが成長しているように見えたりします。これは免疫反応がそれだけ大きく起こっている証拠でもあり、がんが小さくなっていく過程にあることを示しています。しかし、シュード・プログレッションに見えたものが、実はがんの増殖であるケースもあるため、注意深い観察が大切となります。
免疫チェックポイント阻害薬の併用療法
免疫チェックポイント阻害薬による治療効果が得られる患者さんを増やすため、治療薬を併用する研究が盛んに行われています。
たとえば、PD-1とCTLA-4に対する薬では明らかに作用メカニズムが異なります。そこでニボルマブ(抗PD-1抗体)とイピリムマブ(抗CTLA-4抗体)の併用療法について臨床試験を行ったところその有効性が確かめられ、メラノーマについては2018年5月、腎細胞がんについては同年8月に承認されました。肺がんや頭頸部がん、胃がん、悪性胸膜中皮腫、食道がん、尿路上皮がんなどについても臨床試験が行われています。
また、免疫チェックポイント阻害薬と従来からある殺細胞性の抗がん薬や分子標的薬との併用についても、有効性と安全性を確かめる臨床試験が行われています。
すでに免疫チェックポイント阻害薬と殺細胞性抗がん剤の併用により臨床効果が向上したという報告もあります。殺細胞性抗がん剤は免疫にも作用しているという報告があり、免疫チェックポイント阻害薬との併用により免疫が増強されることが考えられます。
同様に分子標的薬との併用にも免疫にプラスに働くものがあります。たとえば、分子標的薬のイマチニブ(製品名:グリベック)などは免疫調節剤としても働いていて、免疫増強のための有効成分として使うことが可能だといわれています。
ほかにも放射線治療との併用療法についても臨床試験が進行中です。
免疫チェックポイント阻害薬の基本的な使い方
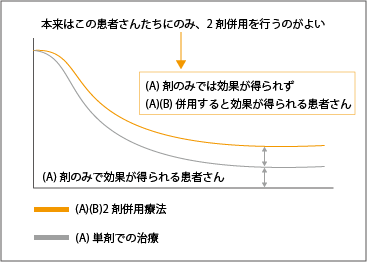
併用療法についても、免疫チェックポイント阻害薬を用いる場合はぜひとも考慮してほしいことがあります。それは単剤で非常に高い効果が出ている患者さんが2割いるということです。この点は従来の殺細胞性の抗がん薬との大きな違いです。従来の抗がん薬の場合、全ての患者さんで単剤で用いるより他の薬と併用したほうがよく効き、長期生存する人も増えていきます。
しかし、そのような考え方が当てはまらないのが、免疫チェックポイント阻害薬などの免疫に働きかける製剤です。単剤の治療でも2割の患者さんは、10年以上生存しているのですから、単剤で効く患者さんに「さらによく効く場合があるから」と併用療法を行えば、必要のない余計な治療になってしまいます(図4参照)。免疫チェックポイント阻害薬に代表される免疫療法は、「必要な種類の薬を必要な量だけ必要なときに投与する」のが基本なのです。
免疫チェックポイント阻害薬の近未来と期待
免疫チェックポイント阻害薬の今後を見据えると、治療効果の予測や有害事象が懸念される患者さんを識別できるバイオマーカーを早期に見つけることが課題となっています。
同時に、従来のがん治療の“常識”に収まらないのが免疫チェックポイント阻害薬をはじめとした新しいがん免疫療法の特徴ですから、がん治療の考え方を変えていく必要があるかもしれません。
たとえば、通常は、がん治療というと大腸がん、肺がん、胃がん、乳がんなど、臓器ごとにがんをとらえて治療しますが、免疫チェックポイント阻害薬による治療ではそれが当てはまらない場合があります。そもそも臓器ごとのがん種は人間が決めたものです。より生物学的に考えるなら、どんな性質をもつがん細胞なのかという識別こそが重要です。これまで、がんの完治をめざす一番の方法はがんを切除する外科療法だったため、がんがどこにあるかという“場所”が大事でした。しかし、がん免疫療法のように切除ではない方法で治すとき、大切なのはがんの生物学的特性を理解することです。
現在、分子標的薬治療でALKやEGFR、HER2などの遺伝子変異を対象とする場合も、がん種を超えた治療が検討されています。実際に、HER2陽性乳がんの治療薬トラスツズマブ(製品名:ハーセプチン)は、HER2陽性で治癒切除不能な進行再発の胃がんに対しても投与が可能となっています。
がん免疫療法でもがん種を越えた薬が登場しようとしています。2018年3月、局所進行性または転移性の高頻度マイクロサテライト不安定性(MSI-High:microsatellite instability-high)がんに対して抗PD-1抗体ペムブロリズマブ(製品名:キイトルーダ)の承認申請が行われました。
MSI-Highとは、傷ついた遺伝子の修復機能異常を示すバイオマーカーのことです。私たちの体の中の遺伝子はさまざまな理由で傷ついており、がん細胞はその傷ついた遺伝子により発生しますが、傷は常に修復されるため、滅多にがん化することはありません。ところがMSI-High腫瘍では、修復機構が異常を来し、遺伝子に複数の傷が生じる事態となってしまいます。
MSI-High検査で陽性を示すがんは、大腸がんや胃がんなどの消化器系のがんをはじめ、がん種を越えて、臓器横断型に発生しています。このようながん種を越えたMSI-High陽性のがんに有効なのがペムブロリズマブをはじめとする免疫チェックポイント阻害剤です。米国では世界初のがん種を越えた薬として2017年5月に承認されており、日本においても早期承認が期待されています。
この承認に先駆け、がん組織から抽出したゲノムDNA中のMSI-High検査が2018年9月に承認されました。ペムブロリズマブの局所進行性または転移性のMSI-Highがん患者さんへの適応を判定するための補助として使うことができるようになりました(11月現在は保険未収載)。
プロフィール
西川博嘉(にしかわ・ひろよし)
2002年 三重大学大学院医学研究科内科学専攻修了 博士(医学)。三重大学医学部附属病院 内科医員
2003年 Memorial Sloan Kettering Cancer Center, Research fellow
2006年 三重大学大学院医学系研究科病態解明医学講座 講師
2010年 大阪大学免疫学フロンティア研究センター実験免疫学 特任准教授
2012年 Department of Oncology, Roswell Park Cancer Institute, Adjunct Associate Professor(兼任)
2015年 国立がん研究センター研究所 腫瘍免疫研究分野/先端医療開発センター 免疫トランスレーショナルリサーチ分野 分野長
2016年 名古屋大学大学院医学系研究科 微生物・免疫学講座 分子細胞免疫学 教授(クロスアポイントメント)

