希少がん治療、がん種から遺伝子へ―希少がん患者と治験をつなげるMASTER KEYプロジェクトとは
2019.3 取材・文:町口 充
年間の発症数が人口10万人あたり6例未満の「希少がん」は、発症が稀ながんの総称です。稀であるがゆえに診療や研究の体制が整わず、有効な治療法の開発が遅れています。近年、遺伝子とがんの研究が進み、がんの部位ではなく遺伝子タイプに合わせた治療の研究と開発が進んだことで、既存の分子標的薬が希少がんでも効果が期待できる可能性がでてきています。そこで国立がん研究センターは2014年に希少がんセンターを開設したのに続き、2017年からは産学共同プロジェクトとして希少がん治療の研究開発およびゲノム医療を推進しようと、「MASTER KEYプロジェクト」をスタートしました。患者さんにも参画を呼びかけてさまざまな取り組みを行っており、1日でも早く有効な新薬を届けるための治験(臨床試験)も進行中です。
希少がんが抱える問題
希少がんは、「年間発症数が人口10万人あたり6例未満のがん」と定義されています。いわゆるコモンキャンサーといわれる患者数が多い一般的ながんでは、大腸がんが10万人あたり105.5人、胃がんが99.0人、肺がんが88.4人※1であるのに比べれば、かなりの少なさです。
具体的ながん種でいうと、口腔がん、卵巣がん、尿路がん、さまざまな種類の血液がん、肉腫(サルコーマ)などがあります。肉腫は全身の骨や軟部組織(脂肪、筋肉、神経など)で発生するがんの総称であり、多数の種類があります。これらのほか、悪性脳腫瘍、GIST(消化管間質腫瘍)、皮膚がん、眼のがん、頭頸部がん、中皮腫、神経内分泌腫瘍など多岐にわたり、200種類に及びます(表1参照)。
しかし、こうした希少がんについては、それぞれの患者数が少ないことから多くの製薬会社は必ずしも積極的に治療薬を開発・販売してはいません。新薬の開発には10年はかかるといわれています。労力と資金をかけて研究開発や治験を行い薬の効果が証明できたとしても、少数の患者さんしか対象にならないとなれば、どうしてもそこに市場原理が働き、肺がんや大腸がん、乳がんなど、コモンキャンサーのほうに力が注がれてしまうのです。結果として、コモンキャンサーの薬は次々と承認されるものの、希少がんの薬はなかなか開発されません。
そもそも患者さんの数が少ないために治験からして行えないという問題もあります。新薬の承認に向けた臨床試験には第I相、第II相、第III相があり、最終関門の第III相臨床試験はより検証性を高めた大規模なランダム化比較試験として行われます。これは500人、1000人という多数の患者さんを募集して、くじ引きで無作為(ランダム)に2つの集団に振り分け、既存の薬と治療効果を比較する試験です。多数の患者さんを必要とするこのような試験は、患者さんの数が少ない病気では難しいのです。
つまり、製薬会社がなかなか開発に乗り出そうとしないことに加え、治験をしようにもできない、したがってたとえ開発に成功しても新薬として承認されないという、二重三重の悪循環に陥っているのが希少がんです。
医療者側の問題もあります。たとえば、肺がんであれば、病理医も臨床医も常にたくさんの患者さんを診ていて知識も経験も豊富です。しかし、稀ながんの患者さんを診る機会は極めて少なく、1年に1回とか、なかには一生に1回しか診ない疾患もあります。病理医も臨床医も慣れておらず、知識が不足したり、病気を特定するための特殊な検査ができないために、正確な診断が難しい場合もあります。
表1 希少がんの種類
| 領域 | がん種や主な診断名、病型など | |
|---|---|---|
| 脳・脊髄領域 | 脳腫瘍 | 毛様細胞性星状細胞腫、びまん性星細胞腫、乏突起膠腫・乏突起星細胞腫、退形成性星細胞腫、退形成性乏突起膠腫・退形成性乏突起星細胞腫、膠芽腫、上衣腫、退形成性上衣腫、神経節膠腫、中枢性神経細胞腫、髄芽腫、胚腫、中枢神経系悪性リンパ腫、髄膜腫、神経鞘腫、GH産生下垂体腺腫、PRL産生下垂体腺腫、ACTH産生下垂体腺腫、非機能性下垂体腺腫、頭蓋咽頭腫、脊索腫、血管芽腫、類上皮腫、など150分類 |
| 眼領域 | 眼腫瘍 | 網膜芽細胞腫、脈絡膜悪性黒色腫、眼内リンパ腫、眼瞼腫瘍、涙腺がん、眼付属器リンパ腫、眼窩肉腫、視神経腫瘍 |
| 頭頸部領域 | 聴器がん 口腔がん 腺様嚢胞がん 嗅神経芽細胞腫 頭頸部の肉腫 | |
| 呼吸器・縦隔領域 | 悪性胸膜中皮腫 胸腺腫・胸腺がん 神経内分泌がん 神経内分泌腫瘍 胚細胞腫瘍 | |
| 消化器・肝胆膵領域 | 悪性腹膜中皮腫 肛門がん GIST(消化管間質腫瘍) 小腸がん 神経内分泌がん 神経内分泌腫瘍 膵・消化管神経内分泌腫瘍 | 十二指腸がん、空腸がん、回腸がん |
| 内分泌領域 | 副腎がん | |
| 泌尿器・生殖器領域 | 子宮の肉腫 神経内分泌がん 神経内分泌腫瘍 腟がん・外陰がん 尿膜管がん 胚細胞腫瘍 腹膜がん | がん肉腫、平滑筋肉腫、子宮内膜間質肉腫 |
| 皮膚領域 | 皮膚腫瘍 | 基底細胞がん、有棘細胞がん、乳房外パジェット病、メルケル細胞がん、汗腺がん、脂腺がん、毛包がん、悪性黒色腫、隆起性皮膚線維肉腫、血管肉腫、類上皮肉腫、平滑筋肉腫、脂肪肉腫、未分化多形細胞肉腫、など |
| 肉腫 | 後腹膜の肉腫 骨の肉腫 体幹の肉腫 デスモイド腫瘍 軟部の肉腫 胞巣状軟部肉腫 明細胞肉腫(淡明細胞肉腫) | 骨肉腫、軟骨肉腫、ユーイング肉腫、骨巨細胞腫 |
| 血液・リンパ領域 | 悪性リンパ腫 白血病 多発性骨髄腫 骨髄異形成症候群 | びまん性大細胞型B細胞リンパ腫、濾胞性リンパ腫、MALTリンパ腫、末梢性T細胞リンパ腫、マントル細胞リンパ腫、成人T細胞白血病/リンパ腫、など、80ほどの病型 急性骨髄性白血病、慢性骨髄性白血病、急性リンパ性白血病、慢性リンパ性白血病 |
| 小児 | 胎児性腫瘍 | 神経芽腫、網膜芽腫、腎芽腫、肝芽腫、胚細胞腫瘍 |
| 小児の肉腫 | 骨肉腫、ユーイング肉腫ファミリー腫瘍、横紋筋肉腫 | |
| 原発不明 | 原発不明がん | |
※1:国立がん研究センターがん情報サービス:「がん登録・統計」地域がん登録全国推計による罹患データ(2014年)
希少がん対策と診療
希少がんはこれまで、がん治療の進歩から取り残される傾向が否めませんでしたが、「希少がんは決して希少ではない」と視点を転換し、治療開発を推し進める動きが出てきています。
たしかに、それぞれのがん種ごとの患者数は少ないですが、日本では希少がんの患者数の総計はがん全体の約15%を占めていて、決して少なくはないのです(図1、2、3参照)。数にすれば、毎年約10万人が新規に希少がんと診断されています。これは肺がんの新規罹患数約11万人(2014年)に匹敵する数字です。希少がんの患者さんに有効な治療法を届けることは、たくさんの命を救うための重要な取り組みなのです。
このため、国も希少がんの治療開発に力を入れる方針を示しており、国立がん研究センターでは2014年に希少がんセンターを立ち上げ、複数の診療科の臨床医が連携して希少がんの診療に対応する体制の構築を始めました。
希少がんセンターの開設以来、年間6000件近くの問い合わせや相談が日本中から寄せられています。6000件のうちの半分ほどは患者さん自身からのもので、残りの3分の1は患者さんの家族、3分の1は医療者からです。コモンキャンサーについての情報は書籍やインターネットサイトなどから簡単に入手できますが、希少がんでは情報が極端に少なく、寄せられる困りごとに答えながら、医療についての相談に積極的に応じています。
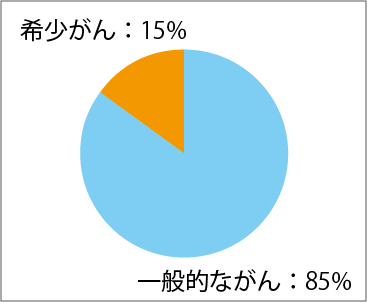
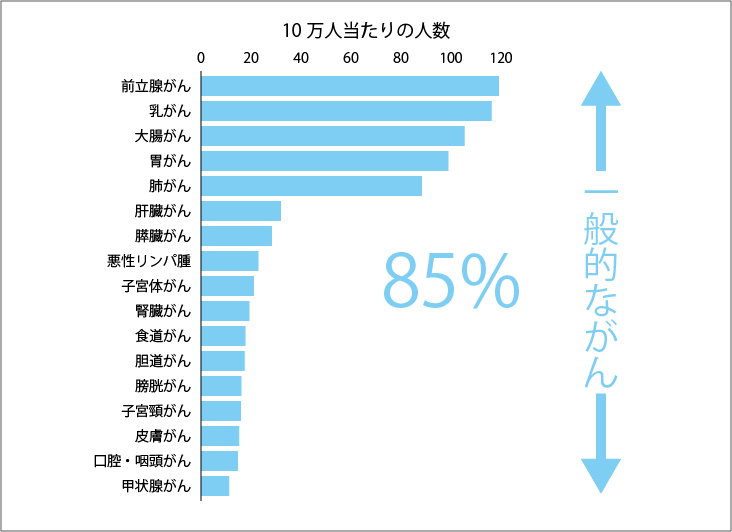
前立腺がんは男性10万人あたり、乳がん、子宮体がん、子宮頸がんは女性10万人あたりの罹患数
国立がん研究センターがん情報サービス:「がん登録・統計」地域がん登録全国推計による罹患データ(2014年)より作成
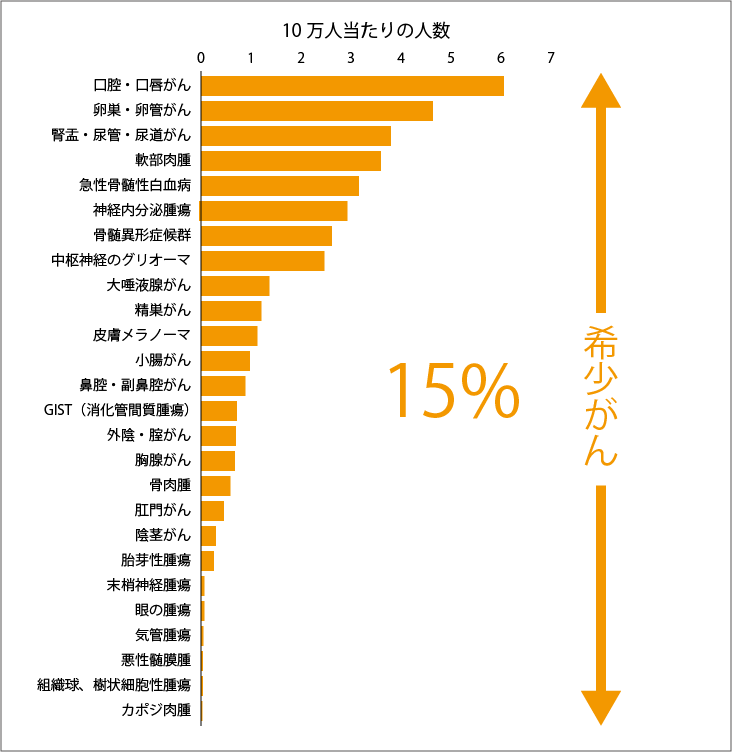
国立がん研究センターがん対策情報センター:厚生労働省委託事業「希少がん対策推進事業」希少がん対策ワークショップ報告、2014より作成
希少がんの課題解決のためのプロジェクト
希少がんが抱える問題や課題を解決するために、MASTER KEYプロジェクトを2017年5月からスタートさせました。
MASTER KEYとは「Marker Assisted Selective ThErapy in Rare cancers・Knowledge database Establishing registrY project」の略語で、「希少がんにおけるマーカー支援選択療法・知識データベースレジストリプロジェクトの確立」の頭文字を取ったものです。希少がんの研究開発およびゲノム医療を推進する製薬会社などとタイアップした産学共同のプロジェクトです。現在、11の企業と研究施設をもつ2つの病院が参画しています(表2参照)。
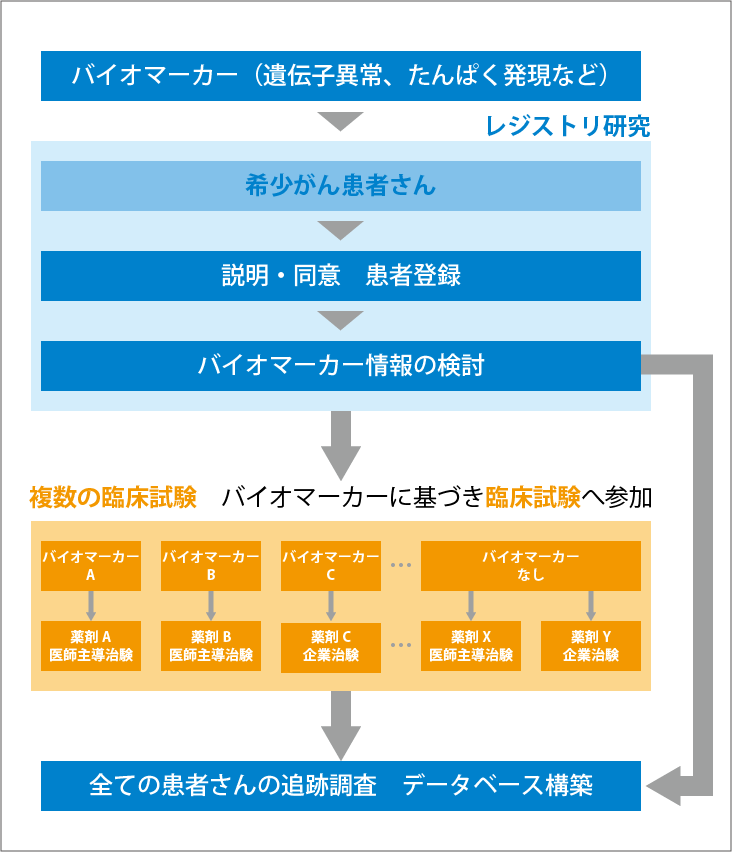
このプロジェクトは、「レジストリ研究」と「治験(副試験)」の2つのパートに分かれています(図4参照)。
レジストリとは直訳すれば登記、記帳の意味です。IT関連用語ではシステム情報を管理するデータベースのことですが、医療の分野では患者さんの疾患や治療の内容、治療経過などを管理するデータベースを意味します。
1つめのパートの「レジストリ研究」では、これまでまとまった臨床情報が蓄積されてこなかった希少がん患者さんの大規模なデータベースを蓄積することで、それぞれの遺伝子異常の情報を含む希少がんの特性を明らかにするのが目的です。患者さんはこのレジストリ研究に登録し、バイオマーカーや遺伝子検査などの結果、条件を満たせば、2つめのパートで行われる治験に参加できます。希少がんはこれまで治療の選択肢が限られていましたが、レジストリ研究に登録することで治験への参加の道が開かれ、より多くの治療機会を得ることになると期待されています。
表2 プロジェクトにおける産学共同
| 医療機関 | レジストリ研究/臨床試験を実施 | 国立がん研究センター中央病院 |
|---|---|---|
| 京都大学医学部附属病院 | ||
| 2019年4月~北海道、九州に1病院ずつが参加予定 | ||
| 製薬企業 | シーズと研究資金の提供、希少がん治療薬の開発/臨床試験の実施 | アステラス製薬 |
| エーザイ | ||
| 小野薬品工業 | ||
| キョーリン製薬 | ||
| 第一三共 | ||
| 大鵬薬品 | ||
| 武田薬品工業 | ||
| 中外製薬 | ||
| ノバルティスファーマ | ||
| ファイザー製薬 | ||
| ignytas |
希少がんのほか、希少タイプのがんも対象
レジストリ研究では、一般的に希少がんと呼ばれるがんの患者さん以外にも参加の門戸を開いており、希少がんと同様に発症数の少ない原発不明がん、コモンキャンサー(大腸がん、胃がん、肺がん、乳がんなど)の中でも希少な病理組織型のがん、子どものがんも対象となります(表3参照)。
原発不明がんとは、精密検査を行っても原発巣(がんが最初に発生した臓器)がはっきりせず、転移病巣だけが大きくなったがんのことをいいます。病巣となる臓器はさまざまですが、原発不明がんと診断される人の総計は、成人固形がんの3~5%を占めるといわれています。
コモンキャンサーのなかには、病理組織型が希少ながんがあります。たとえば乳がんにもさまざまなタイプがあり、いちばん多いのは浸潤性乳管がんですが、扁平上皮がんや小細胞がんはそれぞれ全体の3%ほどしか発症例がありません。さらに、化生がん(メタプラスティック・カルチノーマ)という特殊型乳がんに分類されるがんは、発症は乳がん全体の1%とされ、治療方法も通常の乳がんとは考え方を変える必要があるといわれながら、実際には同じ治療が行われることが多いようです。
子どものがんは発症数が少なく希少がんにあたるため、レジストリ研究には1歳以上であれば登録できます。成人に対しては成長面への影響などはあまり考慮せずに抗がん剤などの強力な治療を行いますが、成長途上にあり、骨格・臓器・生殖機能がこれから発達していく子どもに対しては、年齢にふさわしい薬が開発される必要があります。しかし現実には、患者さんの数が少ないこともあって製薬会社の取り組みもなかなか進みません。この点を改善するためにもMASTER KEYプロジェクトへの子どもの患者さんの参画は大きな意義があります。
表3 レジストリ研究の対象
| ●以下のように診断されている |
| 希少がん(年間発症数が人口10万人6例未満) |
| 原発不明がん |
| 主要ながん(胃がん、大腸がん、肺がん、乳がん、肝臓がん)のうち、希少な病理組織型 |
| ●1歳以上である |
| ●治癒不能な進行性(転移性、および/または切除不能)の病変がある |
| ●バイオマーカー検査を受けているか、受けることに同意できる |
2つのがん遺伝子パネル検査
レジストリ研究において、がん細胞の遺伝子異常を調べるうえで欠かせないのが、バイオマーカー検査や遺伝子検査です。このうちバイオマーカーは、血液や尿あるいは体の組織に含まれるタンパク質や遺伝子などのデータで、がんの悪性度や治療に対する反応に相関しているため、治療法の効果を予測し選択するための指標の1つとなっています。
さらに最近は、次世代シークエンサーと呼ばれる遺伝子の塩基配列を高速に読み出せる最新鋭の装置が登場したことで、遺伝子検査は格段に進歩しています。患者さんの診断や治療に役立つ情報を得るために、一度に複数の遺伝子変異を調べることができる「がん遺伝子パネル検査」と呼ばれる新しい検査法が登場するようになってきました。
2018年12月には、2つのがん遺伝子パネル検査が保険適用となり、医療の現場で広く活用されるようになっています。
1つは、国立がん研究センターと医療機器メーカーのシスメックス社が共同で開発した日本人のための国産ゲノムプロファイリング検査「OncoGuideTM NCCオンコパネルシステム」で、次世代シークエンサーによる解析で114の固形がん関連遺伝子の変異について一度の検査で調べられるようになりました。
もう1つは「FoundationOnea® CDxがんゲノムプロファイル」というやはり次世代シークエンサーを用いた遺伝子変異解析システムです。中外製薬が米国ファウンデーション・メディシン社から導入したもので、324の固形がん関連遺伝子の変異を調べることが可能になっています。
また、患者さんのがん細胞を免疫不全マウスに植えつけて、いろいろな薬を投与してみて効果の高い薬を調べる「PDX(patient–derived xenograft)」という手法を用いた抗がん剤の評価法があります。このプロジェクトでは、この手法を用いて最先端の検査・治療法を開発することも計画されています。
従来の抗がん剤の開発では、患者さんに投与する臨床試験を行う前に、実験用に用いる細胞株を使ってマウスなどに投与して薬効の評価を行います。ただし、実験用の細胞株では元のがん組織の特性が失われているため、抗がん剤の正確な効果を予測できないことがあると指摘されていました。そのため近年では、患者さんのがん組織をこのPDXモデルマウスと呼ばれる免疫不全マウスに移植し腫瘍を再現する方法の利用が進んでいます。従来の実験モデルで5%程度といわれる治療効果の予測能が、PDXモデルマウスを用いた場合には80%以上が得られるという報告があります。
PDXによる評価法はがん治療薬の開発に利用されていますが、希少がんの場合、臨床試験に必要な数の患者さんが集まらず、臨床試験を組むことが難しいため、特に有効な手法といえます。実験用の細胞株でさえ存在しないために動物実験による研究もできないという現実もあるからです。希少がんに対するPDX研究が新薬開発の糸口になることが期待されています。
がん種から遺伝子タイプによる治療へ
がん遺伝子パネル検査に代表されるような遺伝子解析技術の著しい進歩は、がんの治療を大きく変えようとしています。
これまでのがんの治療は、胃や肺といった発症臓器による分類をもとに治療法が考えられ、胃がん、肺がんなど、がん種ごとに治療法が異なるのが普通でした。しかし、近年の研究で、がんはさまざまな遺伝子異常が積み重なって発症し、たとえがん種としては同じでも、がん細胞に起こっている遺伝子異常は個々の患者さんごとに違うことがわかってきました。
たとえば肺がんにしても、肺がんの大部分を占めるのは非小細胞肺がんですが、遺伝子変異でみると実は“希少がんの集合”であるといわれています。割合として多いのはEGFR遺伝子変異で、これが30~40%を占めます。ほかにALK融合遺伝子、ROS1融合遺伝子、RET融合遺伝子などがあり、それぞれ5~1%です。このため、EGFR遺伝子変異陽性の非小細胞肺がんに対してはEGFR阻害薬が有効ですが、ALK融合遺伝子陽性例に対してはALK阻害薬を使った治療を行うなど、遺伝子のタイプによって治療法も異なります。
このようにがんの治療は、従来の「がん種別の治療」から「遺伝子別の治療」に変りつつあります。
同じことは希少がんに対してもいえます。がん種としては骨肉腫や悪性脳腫瘍に分類されるがんであっても、遺伝子でみると違った分け方ができるのです。
たとえば、希少がんである肉腫の1つに炎症性筋繊維芽細胞性腫瘍(IMT)という病気がありますが、これは小児や若年成人に発生することが多い軟部肉腫です。この病気の半数の患者さんでは、遺伝子の異常としてALK遺伝子と何らかの遺伝子が融合してしまう(遺伝子再構成)ことが知られていいます。その場合にはクリゾチニブ(製品名:ザーコリ)をというALK阻害薬が有効である可能性が示されていて、海外の臨床試験では有効性を示唆する結果も明らかになっています。しかし、クリゾチニブはALK融合遺伝子陽性の肺がんにのみ保険適用となっていて、それ以外の疾患では基本的に使用することができません。その後、肺がんに対してはやはりALK阻害薬であるアレクチニブ(製品名:アレセンサ)など3薬が保険適用になっていますが、これもIMTには認められていません。
ほかにも、コモンキャンサーと同じような遺伝子変異をもつがんであるのに、コモンキャンサーでは治験が行われて使用が認められている治療薬を、希少がんでは治験が行われないために使用できないというケースが少なくありません。
もちろん、希少がんのなかには遺伝子変異のタイプでは治療法の区分けができない疾患もあり、疾患ごとに治療法を特定する場合もありますが、それでも、従来と同じような考え方ではがんを正しくとらえることができなくなっているのは確かです。
承認薬による希少がんの治験
そこで期待が寄せられているのがMASTER KEYプロジェクトの2つめのパートである「治験」です。
1つめのパートのレジストリ研究は臨床研究であるのに対して、2つめのパートの治験では、実際に患者さんを対象とした臨床試験を行って治療薬の開発をめざします。レジストリ研究に登録した患者さんのうち、バイオマーカー検査や遺伝子検査などの情報をもとに、特異的に効果が見込まれる分子標的薬治療の実現に向けて医師主導治験、または企業治験を行います。コモンキャンサーですでに使用が認められている薬を希少がんでも使えるようにするには、安全性と有効性を証明する治験が必要であり、それを医師主導あるいは製薬会社が実施主体となって行う取り組みです。現在、3つの企業治験と5つの医師主導治験が行われています(表4参照)。
治験の中にはすでに登録が終了し、結果を追跡中のものがあります。それはノバルティスファーマの企業治験として行われた「ROAR試験」です。
これは、BRAF遺伝子に特定の変異(BRAF V600E)がある希少がんの患者さんを対象に、分子標的薬のダブラフェニブ(製品名:タフィンラー)とトラメチニブ(製品名:メキニスト)の併用療法を検討する第II相試験です。対象となるのは、未分化甲状腺がん、胆道がん、GIST、神経膠腫、NSGCT/NGGCT、小腸腺がん、有毛細胞白血病、多発性骨髄腫です。ダブラフェニブとトラメチニブの併用療法は、2018年、BRAF遺伝子変異を有する非小細胞肺がん、悪性黒色腫に対して承認されましたが、その他のがんへの適用拡大は認められていません。
今回、日本で行われたものと同様の治験は海外でも行われていて、BRAF V600E変異を有する再発・難治性の有毛細胞白血病については結果がまとまり、2018年12月、米国サンディエゴで開催された米国血液学会で発表され、高い効果が報告されています。
表4 現在進行中の治験
試験名:ROAR
- バイオマーカー
(対象疾患) - BRAF600E(希少がん)
- 治験薬
- ダブラフェニブ、トラメチニブ
- フェーズ
- II
- 開始
- 2017年11月
- 状況
- 登録終了追跡中
- 実施者(依頼者)
- ノバルティスファーマ
- 実施施設
- 国立がん研究センター中央病院 他
- 目的
- BRAF V600E変異陽性の希少固形腫瘍、または血液悪性腫瘍に対するダブラフェニブ、トラメチニブ併用療法の全奏効率を明らかにする
試験名:ROCK
- バイオマーカー
(対象疾患) - MSI-High/dMMR(希少がん)
- 治験薬
- ニボルマブ
- フェーズ
- II
- 開始
- 2018年4月
- 状況
- 登録中
- 実施者(依頼者)
- 国立がん研究センター中央病院乳腺・腫瘍内科
- 実施施設
- 国立がん研究センター中央病院
- 目的
- ミスマッチ修復機能異常がある希少がん患者に対するニボルマブ単剤療法の有効性、安全性を評価する
試験名:ROLL
- バイオマーカー
(対象疾患) - なし(希少がん全体)
- 治験薬
- ニボルマブ
- フェーズ
- II
- 開始
- 2018年4月
- 状況
- 登録中
- 実施者(依頼者)
- 国立がん研究センター中央病院 乳腺・腫瘍内科
- 実施施設
- 国立がん研究センター中央病院
- 目的
- ミスマッチ修復機能をもつ希少がん患者に対するニボルマブ単剤療法の有効性、安全性を評価する
試験名:STSTICE
- バイオマーカー
(対象疾患) - HER2(子宮癌肉腫)
- 治験薬
- DS-8201a
- フェーズ
- II
- 開始
- 2018年1月
- 状況
- 登録中
- 実施者(依頼者)
- 国立がん研究センター中央病院乳腺・腫瘍内科
- 実施施設
- 国立がん研究センター中央病院、埼玉医科大学国際医療センター、静岡県立がんセンター愛知県がんセンター中央病院、兵庫県立がんセンター、四国がんセンター、九州がんセンター
- 目的
- 根治切除不能で化学療法歴をもつHER2陽性進行再発子宮がん肉腫患者に対するDS-8201aの安全性、有効性を評価する
試験名:TACKLE
- バイオマーカー
(対象疾患) - ALK(成人希少がん)
- 治験薬
- アレクチニブ
- フェーズ
- II
- 開始
- 2018年7月
- 状況
- 登録中
- 実施者(依頼者)
- 国立がん研究センター中央病院呼吸器内科
- 実施施設
- 国立がん研究センター中央病院
- 目的
- ALK遺伝子異常を有する希少がん患者を対象にアレクチニブの有効性、安全性を評価する
試験名:Ad-SGE-REIC
- バイオマーカー
(対象疾患) - なし(悪性胸膜中皮腫)
- 治験薬
- Ad-SGE-REIC
- フェーズ
- II
- 開始
- 2018年8月
- 状況
- 登録中
- 実施者(依頼者)
- 杏林製薬
- 実施施設
- 国立がん研究センター中央病院 他
- 目的
- 二次治療以降の悪性中脾腫患者を対象にAd-SGE-REICの有効性、安全性を評価する
試験名:E7389-LF
- バイオマーカー
(対象疾患) - なし(腺様嚢胞がん)
- 治験薬
- E7389-LF
- フェーズ
- I
- 開始
- 2018年8月
- 状況
- 登録終了追跡中
- 実施者(依頼者)
- エーザイ
- 実施施設
- 国立がん研究センター中央病院 他
- 目的
- 固形がん患者を対象に、E7389リポソーム製剤を投与した際の最大耐量を決定する
試験名:MADAME PRINCESA
- バイオマーカー
(対象疾患) - MDM2(内膜肉腫)
- 治験薬
- DS-3032b
- フェーズ
- II
- 開始
- 2018年12月
- 状況
- 登録中
- 実施者(依頼者)
- 国立がん研究センター中央病院先端医療科
- 実施施設
- 国立がん研究センター中央病院
- 目的
- MDM2増幅を有する内膜肉腫の患者に対して、DS-3032b単独投与の有効性、安全性を評価する
※2019年3月時点
免疫チェックポイント阻害薬による希少がんの治験
がん種を超えた適用が可能という点では免疫に関係する薬も同様です。希少がんに対する免疫チェックポイント阻害薬ニボルマブ(製品名:オプジーボ)の効果を検証する医師主導の第II相臨床試験としては、ミスマッチ修復機能異常ありと異常なしの2つの治験が行われていて、現在、患者さんの登録を募集中です。
がんは遺伝子が傷つくことによって生じますが、通常、傷はすぐに修復されるためがん化することは滅多にありません。この遺伝子の傷を修復する機構の一種にDNAミスマッチ修復機構があります。この機構が欠損することを「ミスマッチ修復機構欠損」といい、こうした異常があるとがん化のリスクが上昇します。
免疫チェックポイント阻害薬は、こうしたミスマッチ修復異常があるがんに対して効果を発揮しやすいと考えられています。そこでミスマッチ修復異常がある希少がんを対象に行われているのが「ROCK試験」です。
一方で、ミスマッチ修復機能をもつがんであっても、ニボルマブの有効性が確かめられて多くのがんの治療薬として承認されています。がんは免疫チェックホイントの仕組みを利用して免疫システムにブレーキをかけて免疫の攻撃から逃れていると考えられており、免疫システムにかけられたブレーキを外すことによってがん細胞に対する免疫機能を高め、がん細胞を攻撃するように働きかけるのがニボルマブです。こうした薬の作用はがん種に関係なく働いていると考えられ、さまざまな希少がんに対しても有効かどうかを確かめるのが「ROLL試験」で、すべての希少がんを対象にしています。
超希少ながん「内膜肉腫」の医師主導治験
医師主導試験として2018年12月から登録者の募集を開始した「MADAME PRINCESA試験」は、内膜肉腫を対象にした新規のMDM2阻害薬であるDS-3032b(一般名:ミラデメタン)の有効性と安全性を調べる試験です。
内膜肉腫は、心臓や肺動脈などの血管循環に重要な臓器にできる進行の早いがんで、希少がんの中でも発症頻度が極めて低く、10万人に0.1人といわれています。患者さんの約60~70%にMDM2遺伝子の増幅が認められ、実験研究の結果などからもMDM2阻害薬の効果が期待されるものの、患者数が極めて少ないため、これまでは臨床治験が難しいと考えられていました。今回の治験は、医師主導だからこそできるものであり、世界で初めて行われる内膜肉腫のみを対象とした試験です。
また、子宮肉腫を対象に新規の抗体薬物複合体DS-8201a(一般名:トラスツズマブ デルクステカン)の有効性と安全性を調べる医師主導の第II相臨床試験「STSTICE試験」も現在、登録中です。
DS-8201aはFDA(米国食品医薬品局)からHER2陽性の再発・転移性乳がんの治療を対象に「画期的治療薬(Breakthrough Therapy)」の指定を受けている薬であり、乳がんのほか、胃がん、大腸がん、非小細胞肺がんにも有望な薬として期待されています。
子宮肉腫の患者さんでは約半数がHER2陽性であるため、今回の臨床試験が計画されました。
HER2陽性の子宮肉腫を対象にした分子標的薬の治験として、世界初の医師主導治験となります。
ALK遺伝子に異常をもつ成人希少がんを対象としたALK阻害薬アレクチニブの第II相医師主導治験「TACKLE試験」も注目されています。アレクチニブは肺がんの患者さんを対象とした比較試験で、ALK阻害薬の第1世代薬であるクリゾチニブを上回る効果を示したため、今回の治験が計画され、現在も登録中です。
全国に広がる登録体制
MASTER KEYプロジェクトがスタートしてから今年5月でまる2年を迎えます。当初は1年間に100人ほどの患者さんを受け入れる計画で進んできましたが、登録を希望する患者さんの数は日に日に増えて、スタートから2年足らずの2018年12月の時点ですでに登録者は502人となり、当初の予測を上回るペースで進んでいます。裏を返せば、希少がんの患者さんはそれだけ最適な治療を受けたくても受けらない厳しい現実に直面しており、自ら進んで研究に参加して医療を少しでも改善させようという思いの強さの現われといえます。
登録を希望する患者さんを受け入れる施設は、2017年のスタート時は国立がん研究センター中央病院だけでしたが、2018年4月からは京都大学医学部附属病院でも希望者の受け入れを開始しています。2019年4月からは北海道や九州エリアでも患者さんを受け入れる体制をスタートさせる予定です。
今後の受け入れ体制については、希少がんは一般的ながんと違って患者さんの数が少ないうえに専門医も少ないため、ある程度の地域枠のなかで拠点となる医療施設を設けていく必要があります。
国の施策として、全国のどこでも質の高いがん医療を提供できるよう、全国に401のがん診療連携拠点病院、36の地域がん診療病院が指定されていますが(2018年4月1日現在)、がんゲノム医療に特化した診療ができる施設として、2018年2月には全国11の施設が「がんゲノム医療中核拠点病院」に指定され、遺伝子解析を行うことができ、専門の人材を育成するなど、がんゲノム医療を提供する基準を満たした病院として機能しています。また、中核拠点病院と連携してがんゲノム医療を行う「がんゲノム医療連携病院」(全国135か所、2018年10月現在)も発表されていますが、今後のMASTER KEYプロジェクトの取り組みは、こうした施設との連携も大切になってくるでしょう。
また、現在は産学共同プロジェクトということで11の製薬会社が加わって共同の事業を行っていますが、公的支援もぜひとも期待したいところです。国が定める「医療分野研究開発推進計画」にもとづく研究開発を推進する機関として国立研究開発法人・日本医療研究開発機構(AMED)があり、こうした公的機関からの希少がんレジストリへの支援も今後の課題といえるでしょう。
プロフィール
米盛 勧(よねもり・かん)
2007年 国立がんセンター(現・国立がん研究センター)中央病院乳腺・腫瘍内科医員
2007 年~2010年 医薬品医療機器総合機構
2010年 国立がん研究センター中央病院乳腺・腫瘍内科医員
2013年 国立がん研究センター中央病院乳腺・腫瘍内科医長


