食道がんに対するペムブロリズマブ+根治的化学放射線療法の治験
治験の募集状況は、「jRCT 臨床研究等提出・公開システム![]() 」ページでご確認ください。
」ページでご確認ください。
治験名
KEYNOTE-975
根治的化学放射線療法を受ける食道がん患者さんを対象にペムブロリズマブとプラセボを比較する二重盲検無作為化プラセボ対照第3相試験
治験概要:
食道扁平上皮がん、食道胃接合部腺がん、食道腺がんに対する治験。根治的化学放射線療法を受ける患者さんが対象です。
ペムブロリズマブ+根治的化学放射線療法とプラセボ+根治的化学放射線療法を比較して、有効性と安全性で評価する臨床試験です。
登録予定数は、600人。
フェーズは、第3相臨床試験。
試験デザインは、多施設共同、無作為化、並行群間、プラセボ対照、二重盲検試験。
試験群:ペムブロリズマブ+根治的化学放射線療法
対照群:プラセボ+根治的化学放射線療法
全生存期間、無イベント生存期間、有害事象、有害事象による投与中止などで評価します。
疾患解説:食道がん
疾患の詳細は、「食道がんを知る」を参照ください。
治験薬:ペムブロリズマブ
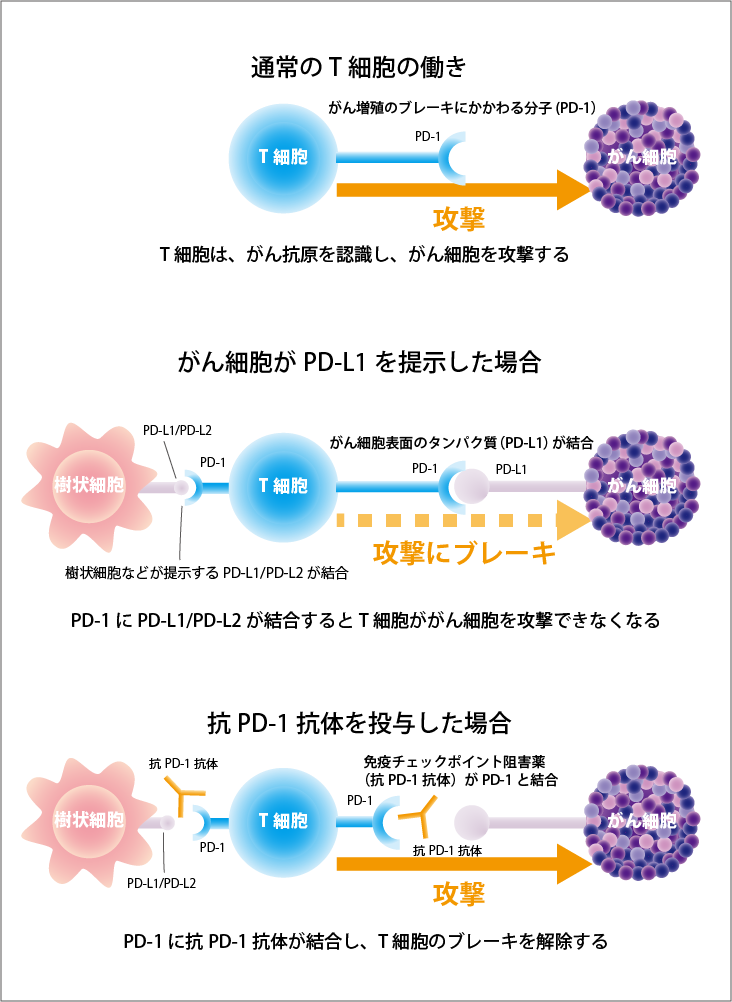
ペムブロリズマブは、抗PD-1抗体という免疫チェックポイント阻害剤の1つです。
免疫チェックポイント阻害薬は、がんに対して、免疫細胞が本来の力を発揮できるようにする薬です。最終的には、免疫の力でがんを攻撃し、治療効果を発揮します。
がん細胞の表面に発現しているPD-L1とがん細胞を攻撃する免疫細胞(T細胞)に発現しているPD-1が結合すると、免疫細胞は、がん細胞を攻撃しなくなってしまいます。この仕組みを「免疫チェックポイント機構」といい、この仕組みが働かないように開発されたのが、免疫チェックポイント阻害薬です。
治験薬:シスプラチン
シスプラチンは、細胞増殖に必要なDNAと結合して、DNAの複製を阻害したり、がん細胞のアポトーシス(細胞死)を誘導することで抗腫瘍効果を発揮する抗がん薬です。
薬の構造中に白金(プラチナ)があるため、白金製剤やプラチナ製剤とよばれることもあります。シスプラチンは、第1世代の白金製剤です。
治験薬:フルオロウラシル
フルオロウラシルは、DNAの合成阻害、RNAの機能障害によるがん細胞を細胞死に誘導する代謝拮抗薬です。
DNAを構成する主な成分はピリミジン塩基といわれ、アデニン、グアニン、シトシン、チミン、ウラシルなどです。フルオロウラシルは、このピリミジン塩基と似たような構造で、DNAが合成されるときにピリミジン塩基の代わりに取り込まれることで、DNA合成を阻害することで、がん細胞の増殖を抑制します。
治験薬:ロイコボリン
ロイコボリンは、フルオロウラシルの抗腫瘍効果を増強する薬です。
フルオロウラシルは、DNAの合成阻害、RNAの機能障害によるがん細胞を細胞死に誘導する代謝拮抗薬です。
DNAを構成する主な成分はピリミジン塩基といわれ、アデニン、グアニン、シトシン、チミン、ウラシルなどです。フルオロウラシルは、このピリミジン塩基と似たような構造で、DNAが合成されるときにピリミジン塩基の代わりに取り込まれることで、DNA合成を阻害することで、がん細胞の増殖を抑制します。
ロイコボリンは、体内でフルオロウラシルの代謝活性物質と強固な複合体を作り、フルオロウラシルの抗腫瘍効果を増強します。
治験薬:レボホリナート
レボホリナートは、フルオロウラシルのDNA合成阻害作用を増強し、抗腫瘍効果を高めるお薬です。
フルオロウラシルの代謝活性物質と一緒にチミジル酸合成酵素と複合体を形成することで、抗腫瘍効果を増強させます。
治験薬:オキサリプラチン
オキサリプラチンは、細胞増殖に必要なDNAと結合して、DNAの複製を阻害したり、がん細胞のアポトーシス(細胞死)を誘導することで抗腫瘍効果を発揮する抗がん薬です。
薬の構造中に白金(プラチナ)があるため、白金製剤やプラチナ製剤とよばれることもあります。オキサリプラチンは、第2世代の白金製剤にさらに改変が行われ、新たな適応を獲得した第3世代の白金製剤です。
治験情報に関する注意点
治験は、治療を兼ねた臨床試験のことです。薬の元となる物質を動物実験などで有効性や安全性を確認した上で、ヒトに対して使用しても同様に安全で治療効果が予測されるもので行われますが、治験の時点ではまだ有効性や安全性が十分に確認できているわけではありません。有効性や安全性が科学的に証明された治療が、標準治療で、新しい治療が必ずしも最良の治療ではないということを理解してください。その一方で標準治療が確立していない、または薬の耐性ができ、効果が期待できる薬がなくなった患者さんにとって治験は新しい治療選択となる可能性もあります。
治験は「ヘルシンキ宣言」に基づく倫理的原則と、「医薬品の臨床試験の実施に関する基準(GCP)」を遵守して行われています。これにより、治験に参加される方の利益が損なわれることがないよう、安全な手続きで治験は進められます。
治験情報を探すとき、治験を受けたいと思ったときは、まず治験とはどのようなものなのかを理解してください。
がんの治験情報をお探しの方に知ってほしい5つのこと
※ここに掲載した情報は、jRCT 臨床研究等提出・公開システム に登録された情報を元にし、がんプラスが独自に記事としてまとめ、提供しています。
※QLife「がん治験情報サービス」でご案内している治験とは異なります。
試験概要詳細
| 試験の名称 | 根治的化学放射線療法を受ける食道癌患者を対象にMK-3475とプラセボを比較する二重盲検無作為化プラセボ対照第III相試験(KEYNOTE 975) |
| 試験の概要 | 本試験の目的は、食道扁平上皮癌患者、プログラム細胞死リガンド1(PD-L1)Combined Positive Score(CPS)10以上の患者、及び患者全体における、全生存期間(OS)及び無イベント生存期間(EFS)を、dCRT+MK-3475群とdCRT+プラセボ群で比較することである 仮説(H1):dCRT+MK-3475はdCRT+プラセボと比較して食道扁平上皮癌患者のOSを延長させる 仮説(H2):dCRT+MK-3475はdCRT+プラセボと比較してPD-L1CPS10以上の患者のOSを延長させる 仮説(H3):dCRT+MK-3475はdCRT+プラセボと比較して患者全体のOSを延長させる 仮説(H4):dCRT+MK-3475はdCRT+プラセボと比較して食道扁平上皮癌患者のEFSを延長させる 仮説(H5):dCRT+MK-3475はdCRT+プラセボと比較してPD-L1CPS10以上の患者のEFSを延長させる 仮説(H6):dCRT+MK-3475はdCRT+プラセボと比較して患者全体のEFSを延長させる |
| 疾患名 | 食道扁平上皮癌・Siewert分類TypeI食道胃接合部腺癌・食道腺癌患者 |
| 試験薬剤名 | MK-3475+根治的化学放射線療法(dCRT) |
| 用法・用量 | MK-3475200mgQ3W8コース その後400mgQ6W5コース(合計約1年間)+dCRT(放射線療法+FOLFOX又はFP) |
| 対照薬剤名 | プラセボ+根治的化学放射線療法(dCRT) |
| 用法・用量 | プラセボQ3W8コース その後Q6W5コース(合計約1年間)+dCRT(放射線療法+FOLFOX又はFP) |
| 試験のフェーズ | フェーズ3/phase3 |
| 試験のデザイン | 多施設共同、無作為化、並行群間、プラセボ対照、二重盲検試験 |
| 目標症例数 | 600 |
| 適格基準 |
|
| 除外基準 |
|
| 主要な評価項目 | 有効性/efficacy |
| 主要な評価方法 | EFS:無作為割付けからイベント[治療対象の食道癌の局所、領域(regional)若しくは遠隔再発、又は原因を問わない死亡と定義]発現までの期間 |
| 副次的な評価項目 | 安全性/safety |
| 副次的な評価方法 | 有害事象 治験薬の投与中止に至った有害事象 |
| 予定試験期間 | 2020年8月18日~2020年2月21日 |
出典:臨床研究等提出・公開システムより

