去勢抵抗性前立腺がん、ペムブロリズマブの有効性・安全性を評価する臨床試験
治験の募集状況は、「jRCT 臨床研究等提出・公開システム 」ページでご確認ください。
」ページでご確認ください。
上記ページにアクセスし、条件欄から「研究の名称」を選択、このページの「試験概要詳細」の「試験の名称」をコピーして、キーワード欄に貼り付け、検索してください。
治験名
転移性去勢抵抗性前立腺癌(mCRPC)の患者を対象としたMK-3475の第II相試験
疾患解説:転移性去勢抵抗性前立腺がん
前立腺がんは、男性ホルモンの刺激によって増殖する性質があるため、手術やホルモン療法(内分泌療法)で男性ホルモンの分泌を抑え、去勢状態にする治療が行われます。ホルモン療法を続けていくと薬の効果が薄れ、がんが再び勢いをましていきます。こうした状態を去勢抵抗性といいます。転移性去勢抵抗性前立腺がんは、去勢抵抗性でなおかつ転移のある前立腺がんの状態です。去勢抵抗性前立腺がんを対象とした治療薬は、現在4剤と、去勢抵抗性前立腺がんの骨転移に対する治療薬が1剤、承認されています。
| 一般名(製品名) | 投与法 | 副作用など |
| 抗アンドロゲン薬 | エンザルタミド(イクスタンジ) | 経口 | 高血圧、疲労感。痙攣性発作、脳梗塞などの既往のある患者さんで強い発作が現れることがある |
| アビラテロン(ザイティガ) | 心疾患、糖尿病の合併症を悪化させる場合がある。肝機能障害。プレドニンを併用する |
| 抗がん剤 | ドセタキセル(タキソテール) | 点滴 | 悪心・嘔吐、脱毛、骨髄抑制、末梢神経障害 |
| カバジタキセル(ジェブタナ) | 骨髄抑制、発熱性好中球減少症、下痢 |
| 放射線治療薬 | ラジウム223(ゾーフィゴ) | 静脈注射 | 貧血、血小板減少、骨痛、下痢など |
治験薬:MK-3475(ペムブロリズマブ)
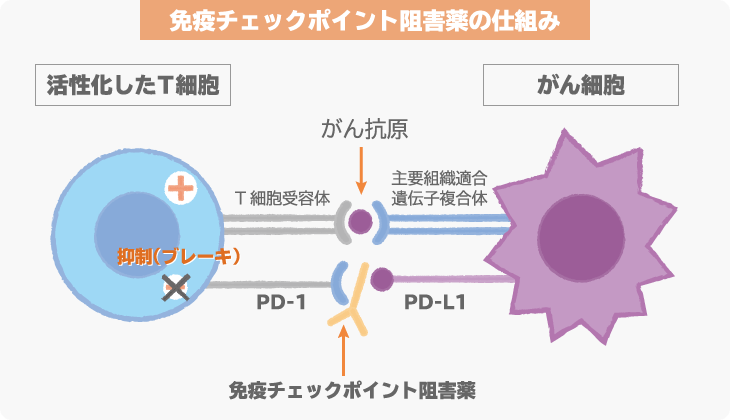
MK-3475(ペムブロリズマブ)は、抗PD-1抗体という免疫チェックポイント阻害薬の1つです。
免疫チェックポイント阻害薬は、がんに対して、免疫細胞が本来の力を発揮できるようにする薬です。最終的には、免疫の力でがんを攻撃し、治療効果を発揮します。
がん細胞の表面に発現しているPD-L1とがん細胞を攻撃する免疫細胞(T細胞)に発現しているPD-1が結合すると、免疫細胞は、がん細胞を攻撃しなくなってしまいます。この仕組みを「免疫チェックポイント機構」といい、この仕組みが働かないように開発されたのが、免疫チェックポイント阻害薬です。
主な治験参加条件
| 対象となる人 |
|---|
- 小細胞がんではない前立腺腺癌であることが確認された患者。
- 過去に放射線照射を受けていない部位から新たに採取した生検検体か12か月以内に採取した腫瘍組織検体、及び可能な場合は保存検体の提出可能な患者(提出検体には諸条件あり)。
- 以下の治療歴を満たす患者
・1レジメン以上の新規ホルモン療法を受けている。
・ドセタキセルを含む化学療法を1レジメン以上受けている。
・化学療法が2レジメン以下である。
・前述の治療(化学療法及び新規ホルモン療法)が3レジメン以下である。
・エンザルタミド投与中に疾患が進行、または疾患進行の初期徴候がみられた患者。
・エンザルタミド投与により臨床的奏効を示した患者。
- 以下の条件で、6か月以内に前立腺がんの疾患進行と治験担当医師が判断した記録がある患者
・PSA 進行:1週間以上間隔を空けて測定したPSA 値が3回以上上昇し、かつスクリーニング時のPSA 値が2 ng/mL 以上の場合。
・画像上の疾患進行:PSA の上昇にかかわらず、軟部組織か骨病変で画像上の疾患進行が認められる場合。
・血清テストステロン値が50 ng/dL 未満(2.0nM未満)のアンドロゲン遮断状態の患者。
・骨吸収療法を受けている場合は、治験薬初回投与 前4週間以上安定した用量で継続している患者。
- PSが0、1、2の患者。
- 治験薬初回投与から治験薬最終投与後120日間、適切な避妊方法への同意。
- 適切な臓器機能が保持された患者。
- 18歳以上
- 男性
|
| 対象とならない人 |
|---|
- 他の治験に参加し、治験薬を投与されている患者。
- 他の治験に参加し、治験薬初回投与前4週間以内に他の治験薬、医療機器を用いた患者。
- 免疫不全状態と診断された患者。
- 治験薬初回投与前7日以内に全身ステロイド療法や他の免疫抑制剤による治療を受けた患者。
- 治験薬初回投与前4週間以内に、抗がん剤治療としてモノクローナル抗体を使用した患者。4週間以上前に使用した前治療薬による毒性から回復していない患者。
- 治験薬初回投与前2週間以内に、化学療法、低分子分子標的薬療法、放射線療法を実施した患者。前治療による毒性から回復していない患者。
- 過去3年以内に、進行した、治療が必要な他の悪性腫瘍がある患者。
- 活動性の中枢神経系への転移、癌性髄膜炎がる患者。
- 活動性の自己免疫疾患を有し、過去2年以内に全身性の治療を必要とした患者。
- 間質性肺疾患の既往、徴候がある患者。
- 全身性の治療を必要とする活動性の感染症がある患者。
- 治験の実施に影響を与える可能性があると判断された精神疾患、物質乱用障害がある患者。
- MK-3475の他の治験に参加した患者、抗PD-1、抗PD-L1、抗PD-L2の治療歴がある患者。
- HIV の既往がある患者。
- 活動性のB型肝炎、C型肝炎がある患者。
- 治験薬投与開始前30日以内に生ワクチンの投与を受けた患者。
- mCRPCに対し化学療法による治療歴がある患者。
- 臨床的な疾患進行、疾患進行の初期徴候がみられる以外に、エンザルタミド投与を直ちに中止する必要がある状態の患者。
|
パフォーマンスステータス(Performance Status:PS)
パフォーマンスステータス(Performance Status:PS)は、米国の腫瘍学の団体(ECOG)が決めた全身状態の指標で、患者さんの日常生活の制限の程度を示します。
| PS 0 | 全く問題なく活動できる 発病前と同じ日常生活が制限なく行える |
| PS 1 | 肉体的に激しい活動は制限されるが、歩行可能で、軽作業や座っての作業は行うことができる 例:軽い家事、事務作業 |
| PS 2 | 歩行可能で自分の身の回りのことはすべて可能だが作業はできない 日中の50%以上はベッド外で過ごす |
| PS 3 | 限られた自分の身の回りのことしかできない 日中の50%以上をベッドか椅子で過ごす |
| PS 4 | 全く動けない 自分の身の回りのことは全くできない 完全にベッドか椅子で過ごす |
出典:Common Toxicity Criteria Version2.0 Publish Date April 30, 1999 (JCOGホームページより引用)
治験情報に関する注意点
治験は、治療を兼ねた臨床試験のことです。薬の元となる物質を動物実験などで有効性や安全性を確認した上で、ヒトに対して使用しても同様に安全で治療効果が予測されるもので行われますが、治験の時点ではまだ有効性や安全性が十分に確認できているわけではありません。有効性や安全性が科学的に証明された治療が、標準治療で、新しい治療が必ずしも最良の治療ではないということを理解してください。その一方で標準治療が確立していない、または薬の耐性ができ、効果が期待できる薬がなくなった患者さんにとって治験は新しい治療選択となる可能性もあります。
治験は「ヘルシンキ宣言」に基づく倫理的原則と、「医薬品の臨床試験の実施に関する基準(GCP)」を遵守して行われています。治験実施にあたり、日本では「医薬品の臨床試験の実施に関する基準(GCP)」という厳しいルールが定められています。これにより、治験に参加される方の利益が損なわれることがないよう、安全な手続きで治験は進められます。
治験情報を探すとき、治験を受けたいと思ったときは、まず治験とはどのようなものなのかを理解してください。
がんの治験情報をお探しの方に知ってほしい5つのこと
※ここに掲載した情報は、jRCT 臨床研究等提出・公開システム に登録された情報を元にし、がんプラスが独自に記事としてまとめ、提供しています。
※QLife「がん治験情報サービス」でご案内している治験とは異なります。
試験概要詳細
| 試験の名称 | 転移性去勢抵抗性前立腺癌(mCRPC)の患者を対象としたMK-3475の第II相試験 |
| 試験の概要 | 本試験は、転移性去勢抵抗性前立腺癌(mCRPC)の患者におけるMK-3475の試験である。被験者は5つのコホート、すなわち、化学療法既治療を対象としたコホート1(PD-L1陽性、RECIST 1.1に基づく測定可能病変あり)、コホート2(PD-L1陰性、RECIST 1.1に基づく測定可能病変あり)およびコホート3(骨転移、RECIST 1.1に基づく測定可能病変なし)、化学療法未治療を対象としたコホート4(RECIST 1.1に基づく測定可能病変あり)、コホート5(骨転移、RECIST 1.1に基づく測定可能病変なし)のいずれかに組み入れられる。 |
| 疾患名 | 転移性去勢抵抗性前立腺癌 |
| 試験薬剤名 | MK-3475(ペムブロリズマブ) |
| 用法・用量 | コホート1、2及び3:MK-3475 200 mg の3週間間隔(Q3W) |
| 用法・用量 | コホート4及び5:エンザルタミド投与中の患者にMK-3475 200 mg を3週間間隔(Q3W)で投与 |
| 試験のフェーズ | フェーズ2(第2相臨床試験) |
| 試験のデザイン | 非無作為化非盲検試験 |
| 目標症例数 | 370 |
| 適格基準 |
- 組織学的又は細胞学的に、小細胞組織構造(小細胞癌)ではない前立腺腺癌であることが確認された患者。診断は、病理報告書に記録され、治験担当医師により確認されなければならない。
- 過去に放射線照射を受けていない部位から新たに採取した生検検体又はスクリーニング開始前12ヵ月以内に採取した腫瘍組織検体、及び可能な場合は保存検体の提出可能な患者。コホート1、2及び4の患者は、全身性治療の最終ライン以降に新たに採取した生検検体又はスクリーニング開始前12ヵ月以内に採取した腫瘍組織検体、及び可能な場合は保存検体を提出しなければならない。コホート3および5の患者は少なくとも保存検体を提出しなければならない。
- コホート1~3のみ:以下の治療歴を満たす患者:
・1レジメン以上の新規ホルモン療法(第二世代の抗アンドロゲン療法として定義され、プレドニゾロン併用のアビラテロン酢酸エス テル、エンザルタミド及びARN-509のような次世代の薬剤が含まれるが、これらに限定しない)を受けている。
・ドセタキセルを含む化学療法を1レジメン以上受けている。
・化学療法が2レジメン以下である。
・前述の治療(化学療法及び新規ホルモン療法)が3レジメン以下である。
- コホート4及び5のみ:
・エンザルタミド投与中に疾患が進行した、又はPCWG3ガイドラインが定義する疾患進行の初期徴候がみられた患者。
・エンザルタミド投与前のアビラテロン投与は許容する。エンザルタミド投与により臨床的奏効を示した患者でなければならない。
・エンザルタミドは治験薬投与開始の4週間以上前から開始し、治験中に継続しなければならない。
- 全コホート:
・以下のいずれかによって、スクリーニング前6ヵ月以内に前立腺癌の疾患進行と治験担当医師が判断した記録がある患者:
a.PSA 進行:1週間以上間隔を空けて測定したPSA 値が3回以上上昇し、かつスクリーニング時のPSA 値が2 ng/mL 以上の場合。
b.画像上の疾患進行:PSA の上昇にかかわらず、軟部組織又は骨病変において、画像上の疾患進行が認められる場合。
- 血清テストステロン値が50 ng/dL 未満(2.0nM未満)のアンドロゲン遮断状態の患者。
- 骨吸収療法(ビスホスホネート製剤又は抗RANKL 抗体が含まれるが、これらに限定しない)を受けている場合は、治験薬初回投与 前4週間以上安定した用量で継続している患者。
- ECOG Performance Status が0、1又は2の患者。
- 生殖能力を有する男性患者は、治験薬初回投与から治験薬最終投与後120日間、適切な避妊方法を使用することに同意しなければならない。
- 適切な臓器機能が保持された患者。
- 年齢:18歳以上
- 性別:男性
|
| 除外基準 |
- 全コホート:
・他の治験に参加中で、かつ治験薬を投与中、又は他の治験に参加し、治験薬初回投与前4週間以内に他の治験薬又は医療機器を用いた患者。
・免疫不全状態と診断された患者、又は治験薬初回投与前7日以内に全身ステロイド療法や他の免疫抑制剤による治療を受けた患者。
・治験薬初回投与前4週間以内に、抗がん剤治療としてモノクローナル抗体を使用した患者、又は4週間以上前に使用した前治療薬による毒性から回復(Grade 1以下又はベースラインまで)していない患者。
・治験薬初回投与前2週間以内に、化学療法、低分子分子標的薬療法、放射線療法を実施した患者、又は前治療による毒性から回復(Grade 1以下又はベースラインまで)していない患者。
・過去3年以内に、進行した又は治療が必要であった他の悪性腫瘍を有する患者。ただし、皮膚の基底細胞癌、根治的治療を受けた皮膚の扁平上皮癌、又は子宮頸部上皮内癌は除く。
・活動性の中枢神経系(CNS)への転移又は癌性髄膜炎を有する患者。
・活動性の自己免疫疾患を有し、過去2年以内に全身性の治療(疾患修飾薬、コルチコステロイド又は免疫抑制剤の使用等)を必要とした患者。
・間質性肺疾患の既往/徴候を有する患者。
・全身性の治療を必要とする活動性の感染症を有する患者。
・治験の実施に影響を与える可能性があると判断された精神疾患又は物質乱用障害を有する患者。
・MK-3475の他の治験に参加した患者、又は抗PD-1、抗PD-L1、抗PD-L2の治療歴を有する患者(イピリムマブ及び、T細胞共刺激又は免疫チェックポイント経路を標的とした抗体又は薬剤を含む)。
・HIV の既往を有する患者。
・活動性のB型肝炎又はC型肝炎を有する患者。
・治験薬投与開始前30日以内に生ワクチンの投与を受けた患者。
- コホート4及び5のみ:
・mCRPCに対し化学療法(ドセタキセルなど)による治療歴を有する患者。
・臨床的な疾患進行、又は疾患進行の初期徴候がみられる以外に、エンザルタミド投与を直ちに中止する必要がある(心臓、神経学的、吸収)状態の患者。
|
| 主要な評価項目 | 中央画像判定機関のRECIST 1.1に基づく奏効率(ORR)(コホート1および2を併せた患者集団、コホート1, 2, および4のそれぞれ) |
| 主要な評価方法 | 治験開始から2年までの中央画像判定機関のRECIST 1.1に基づく奏効率(ORR)を調査する |
| 副次的な評価項目 | 病勢コントロール率(DCR)(コホート1および2を併せた患者集団、コホート1, 2,および3を併せた患者集団、コホート4および5を併せた患者集団、それぞれのコホート毎) |
| 副次的な評価方法 | 治験開始から2年までのDCRを調査する |
| 副次的な評価項目 | Prostate-Specific Antigen(PSA)奏効率(コホート1および2を併せた患者集団、コホート1, 2,および3を併せた患者集団、コホート4および5を併せた患者集団、それぞれのコホート毎) |
| 副次的な評価方法 | 治験開始から2年までのPSA奏効率を調査する |
| 副次的な評価項目 | 有害事象の発現率(すべてのコホートを併せた患者集団、それぞれのコホート毎) |
| 副次的な評価方法 | 治験開始から27か月までの有害事象について調査する |
| 副次的な評価項目 | 有害事象による中止率(すべてのコホートを併せた患者集団、それぞれのコホート毎) |
| 副次的な評価方法 | 治験開始から2年までの有害事象による中止例を調査する |
| 予定試験期間 | 2016年6月~2019年5月 |
出典:医薬品情報データベースiyakuSearchより
![]() 」ページでご確認ください。
」ページでご確認ください。

