がんと免疫「CAR-T療法」血液がんの実績と他がん種への期待

2018.12 取材・文:町口充
外科療法、化学療法、放射線療法に続く、がん治療の第4の柱として免疫療法への期待が高まっています。ノーベル生理学・医学賞の受賞もあって免疫チェックポイント阻害薬が話題になっていますが、さらに最先端のがん免疫療法として注目されているのが遺伝子を改変したT細胞を用いたCAR-T(カーティー)療法です。臨床試験の結果では難治性の急性リンパ芽球性白血病の患者さんの7割から9割に完全寛解が得られたなど、血液がんの治療における高い成績が報告され、ほかのがんへ適応を広げる研究開発も進んでいます。
がんと免疫と免疫療法
私たちの体に備わる免疫システムは、基本的に2つの仕組みから成り立っています。1つは、病原体などの異物が侵入すると直ちに働く自然免疫です。主に好中球やマクロファージ、樹状細胞といった食細胞やNK(ナチュラルキラー)細胞などがここでの主役で、常に全身をパトロールして外敵が侵入すると即座に攻撃します。
自然免疫に続いて働くのが、強い破壊力をもつ獲得免疫です。自然免疫から異物の情報を受け取ると、獲得免疫は自然免疫の監視をかいくぐって増殖を始めたがんに対して攻撃を仕かけます。この獲得免疫で活躍するのはT細胞やB細胞といったリンパ球です。なかでも、がんを攻撃する免疫の主力部隊がT細胞(Tリンパ球)で、強力な細胞殺傷能力をもつキラーT細胞や、さまざまな機能をもったヘルパーT細胞などが連携して働いています。
がん免疫療法には代表的な2つのタイプがあります。1つめが、免疫チェックポイント阻害薬です。がん細胞は自らが生き残るため、T細胞が働かないように免疫システムにブレーキをかけて免疫の攻撃から逃れようとしています。免疫チェックポイント阻害薬は、免疫にかけられたブレーキを解除してT細胞を活性化させることで、がん細胞を攻撃します。
もう1つがCAR-T療法です。T細胞の遺伝子を改変して、がん細胞を狙って攻撃できるより強力な細胞にします。改変されたT細胞を培養して体内に戻し、がん細胞を攻撃する治療法です。つまりアクセルをふかすようにT細胞の力を強めるのが、CAR-T療法です。
CAR-T療法とは
CAR-TのCAR(chimeric antigen receptor)は「キメラ抗原受容体」という意味で、TはT細胞のことです。キメラとは、元々は同一の個体中に異なる遺伝情報をもつ現象をいいますが、CARの場合のキメラは、由来が異なった成分が融合して構成されているという意味です。
がん細胞への攻撃はまず、樹状細胞やマクロファージ、NK細胞といった自然免疫が行います。がん細胞を食べた樹状細胞やマクロファージはがん細胞がもつ目印(抗原といいます)を覚え、「抗原提示」というかたちでT細胞やB細胞へ情報を提供します。「この目印があるヤツががん細胞だぞ!」と教えるわけです。
獲得免疫は抗原提示を受けて、B細胞は抗体を作り、T細胞は活性化してがん細胞への攻撃を始めます。このとき、T細胞が活性化するには、2つのシグナル伝達が必要です。1つは、主要組織適合抗原(MHC)が提示した抗原ペプチドを認識したT細胞受容体(TCR)からのシグナルです。これによって、がん細胞を攻撃すべき異物と認識します。もう1つは、共刺激シグナルと呼ばれ、抗原提示細胞上のある分子とT細胞上のCD28やCD137(4-1BB)といった分子の結合により発生する別経路のシグナルです。2つのシグナルが入った段階でT細胞は十分に活性化され、増殖し、がん細胞を攻撃します。
しかし、がん細胞は免疫から逃れるために、抗原の発現を低下・消失させたり、共刺激分子の発現を低下・消失させるなどして、シグナル伝達を阻害しT細胞の活性化を阻もうとします。
こうしたがん細胞による“免疫回避作戦”に打ち勝つために考え出されたのが、CAR-T療法です。患者さんから採取したT細胞に遺伝子操作によってキメラ抗原受容体をもたせて培養し、患者さんの体に戻す新しい治療法です。このキメラは、抗体の抗原認識部位とTCRのゼータ鎖を融合させ、さらにその間に共刺激シグナル発生ユニットを挟んだものです(図1参照)。これにより、CAR-T細胞は、T細胞でありながら抗体分子でがん抗原の認識を行うため、がんにアタックしやすく、また共刺激シグナルが同時に発生するような構造となっているため、より強力なキラーT細胞に“変身”できるのです(図2参照)。
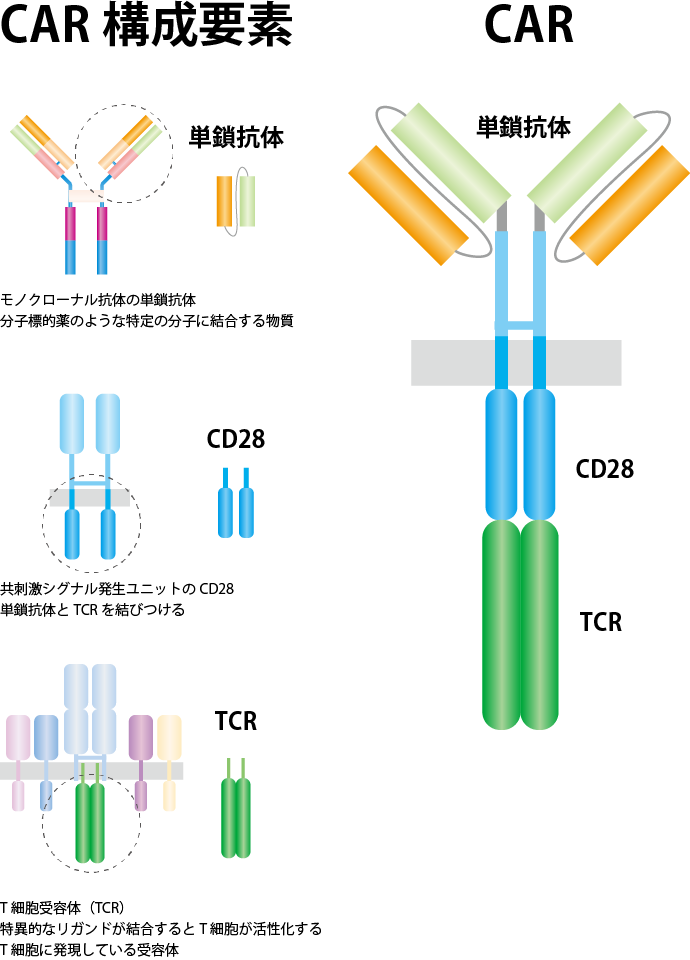
副刺激シグナルユニットとしてCD28を用いた場合を示す。TCRについては、CD3ゼータ鎖が用いられる

CD19特異的CAR-T細胞がCD19抗原陽性のB細胞性腫瘍(白血病や悪性リンパ腫)を破壊する場合を示す
CAR-T療法の実際
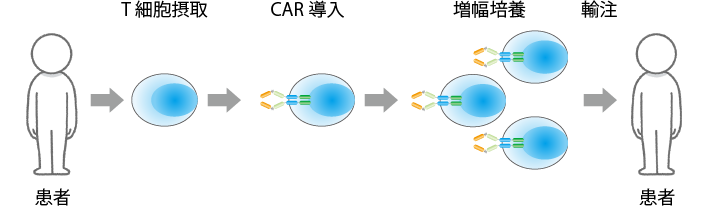
CAR-T療法では、まず、患者さんの末梢血からリンパ球を取り出します(図3参照)。その際、患者さんはベッドに横になった状態で、アフェレーシスという機械で血液を体外循環させて行います。取り出したリンパ球に、ウイルスベクターを使った遺伝子導入によりCARを発現させます。リンパ球の中のT細胞を選択的に増やす条件下で、CARを発現させたT細胞を大量に増幅培養して、輸注(点滴)により患者さんの体に戻します。
ベクターは遺伝子を細胞に運ぶ仕事を受け持つ道具のことで“遺伝子の運び屋”と呼ばれますが、その運び屋の仕事をより効率よくするためにウイルスの力を利用することが多く、ウイルスベクターと呼ばれます。ウイルスを体の中に入れるとなるとインフルエンザなどの病気を連想して「怖い」と感じる人もいるかもしれませんが、ベクターとして使うときは毒性を抜き取ってあるので問題ありません。
培養には10日から2週間程度かかりますが、培養後品質検査などもあり、実際に投与の準備が完了するには2か月ほどかかります。
また、培養したCAR-T細胞を患者さんの体内に戻すときには、前処置として患者さんに抗がん薬の一種であるシクロホスファミド(製品名:エンドキサン)などを投与します。これは、体内のリンパ球を減らすのが目的です。リンパ球中に過剰な免疫反応を抑制する働きをもつ制御性T細胞が多く存在すると、CAR-T細胞の働きを抑えてしまうため、あらかじめ体内の制御性T細胞をたたいておくのです。
CAR-T療法の臨床開発
CAR-T療法では、がん細胞の表面に発現する特定の抗原を標的として認識するように遺伝子を改変しますが、現在のところ劇的な効果が示されているのはCD19という抗原を標的としたCAR-T療法です。B細胞性の白血病やリンパ腫はCD19を高頻度に発現しているため、これらのB細胞性のがんに対するCD19標的CAR-T療法の奏効率はきわめて高いとの報告があります(表1参照)。
たとえば、B細胞性急性リンパ性白血病(B-ALL)に対する米国の臨床試験の結果を見ると、ニューヨークのメモリアルスローンケタリングがんセンター(MSKCC)が行った再発・難治性を対象とした試験では、CR(完全寛解:骨髄中の白血病細胞が5%以下になった状態)を得られた患者さんが91%、ペンシルベニア大学の小児・若年成人対象の試験でもCRが90%など、いずれも驚異的な数字です。
現在、CD19標的CAR-T療法の薬として海外で承認され、使われているのはCTL019(製品名:キムリア)とKTE-C19(製品名:イエスカルタ)です(表2参照)。
2017年8月、米国で小児および若年成人の再発・難治性のB-ALLの治療薬としてキムリアが承認されたのに続いて、同年10月にイエスカルタが再発・難治性大細胞型B細胞性リンパ腫の治療薬として承認されました。さらに、2018年5月にはキムリアの適応が再発・難治性大細胞型B細胞性リンパ腫に広がりました。一方、欧州では、2018年8月にキムリアとイエスカルタが承認されました。
日本では2018年4月、CD19陽性のB-ALLとB細胞性リンパ腫の治療薬としてキムリアの承認申請が行われ、今年度中の承認が見込まれています※。また、CD19陽性B-ALLを対象としたTBI1501の治験が実施されています。
※編集部 注)再発または難治性のCD19陽性B細胞急性リンパ芽球性白血病、および、びまん性大細胞型B細胞リンパ腫に対する治療薬として2019年3月26日に厚生労働省から承認を取得しました。
表1 CAR-T療法の試験と効果
| 施設 | 患者数 | 効果 | CARの組成 |
|---|---|---|---|
| メモリアルスローンケタリングがんセンター | 成人32人 (再発・難治性) | 91%CR (完全寛解) | CD28 CD3ζ |
| ペンシルバニア大学/ペンシルバニア小児病院 | 小児・若年成人30人 | 90%CR (完全寛解) | 4-1BB CD3ζ |
| 米国国立がん研究所 | 小児・若年成人20人 | 70%CR (完全寛解) | CD28 CD3ζ |
| フレッドハッチンソンがん研究センター | 成人20人 | 83%CR (完全寛解) | 4-1BB CD3ζ |
Jackson HD, et al : Driving CAR T-cells forward. Nat Rev 13 : 370-383, 2016.
表2 CAR-T療法薬の対象
| 薬剤(製品名)・解析法 | 適応・対象 | 承認 |
|---|---|---|
| チサゲンレクルユーセル (キムリア) | 小児・若年成人B細胞性急性リンパ芽球性白血病(ALL) | 米国 2017年8月 |
| 再発・難治性びまん性大細胞型B細胞リンパ腫(DLBCL) | 米国 2018年5月 | |
| 小児・若年成人の難治性・移植後等再発B細胞性急性芽球リンパ性白血病(ALL)、再発・難治性びまん性大細胞型B細胞リンパ腫(DLBCL) | 欧州 2018年8月 | |
| 再発または難治性のCD19陽性のB細胞性急性リンパ芽球性白血病 再発または難治性のびまん性大細胞型B細胞リンパ腫 | 日本 2019年3月26日 | |
| アキシカブタゲン シロルユーセル (イエスカルタ) | 成人びまん性大細胞型B細胞リンパ腫(DLBCL) | 米国 2017年10月 |
| 成人びまん性大細胞型B細胞リンパ腫(DLBCL) | 欧州 2018年8月 | |
| 再発または難治性の大細胞型B細胞リンパ腫 ・びまん性大細胞型B細胞リンパ腫 ・原発性縦隔大細胞型B細胞リンパ腫 ・形質転換濾胞性リンパ腫 ・高悪性度B細胞リンパ腫 | 日本 2021年1月22日 | |
| リソカブタゲン マラルユーセル (ブレヤンジ) | 再発または難治性の大細胞型B細胞リンパ腫 ・びまん性大細胞型B細胞リンパ腫 ・原発性縦隔大細胞型B細胞リンパ腫 ・形質転換低悪性度非ホジキンリンパ腫 ・高悪性度B細胞リンパ腫 再発または難治性の濾胞性リンパ腫 | 日本 2021年3月22日 |
CAR-T療法の臨床試験で分かってきたこと
CAR-T療法の治療薬は、投与すると効果が長続きするのが特徴の1つです。CAR-T細胞に付与されたシグナルは、T細胞をキラーT細胞として活性化させるだけでなく、増殖シグナルも併せ持っているため、標的を認識すると体内でキラーT細胞が続々と増えます。このため、がん細胞を攻撃する効果が長く続きます。臨床試験の結果からは、CAR-T細胞は体内で1000倍ほどに増え、しかも半年から1年以上も体内に残って効果を発揮し続けることがわかっています。
このため、CAR-T療法は基本的に1回だけの投与で治療が完了します。
ただし、CAR-T細胞の効果が長く続いてよい成績を示す場合と、そうでない場合があることも明らかになっています。
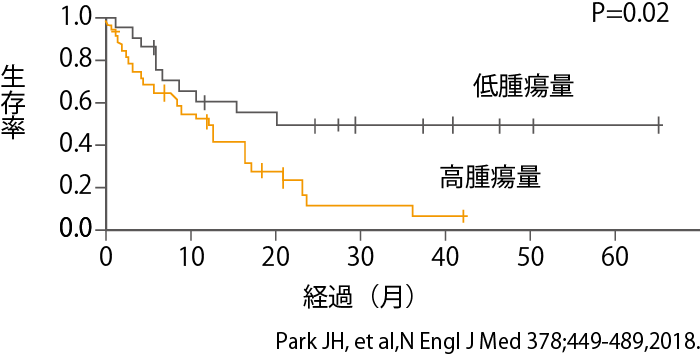
MSKCCでの臨床成績によると、再発・難治性成人B-ALLの患者さん53例にCAR-T療法を行ったところ、83%の症例でCRを得ました。しかし、長期経過観察を行うと、末梢血白血球中の芽球(blast)と呼ばれる異常細胞が5%以下になった寛解状態でCAR-T療法を行うと全生存期間の中央値が20.1か月であったのに対し、芽球が5%以上あった患者さんにCAR-T療法を行った場合は、全生存期間の中央値は12.4か月と差が出ました(図4参照)。
すなわち、治療前の腫瘍量の多少で治療後の生存率に大きな差が生じることが分かったわけです。治療前の腫瘍量が少ない、つまり白血病細胞が少ない状態でCAR-T療法を受けた患者さんでは、20か月ぐらいまでは亡くなる人もいますが、それ以降は生存曲線がほぼ水平に伸びています。一方、白血病細胞の腫瘍量が多い状態で治療を受けた患者さんでは、生存率は下がり続けます。
こうしたことから、CAR-T療法を受けるにあたっては、できる限り体内に残存するがん細胞を少なくしてからCAR-T細胞による治療を開始したほうがより大きな効果を期待できるといえます。
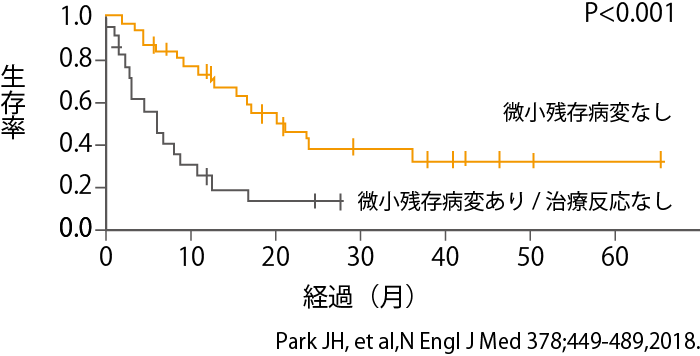
さらに、CAR-T療法でより深い完全寛解が得られた患者さんのほうが、当然ではありますが、その後の経過が良好であることが示されました(図5参照)。微小残存病変が消失した患者さんの経過観察では、3年程度経つと、生存率が下がらなくなっています。すなわち、その一部の患者さんでは治癒が得られた可能性があると思われます。
CAR-T療法後の造血幹細胞移植の意義
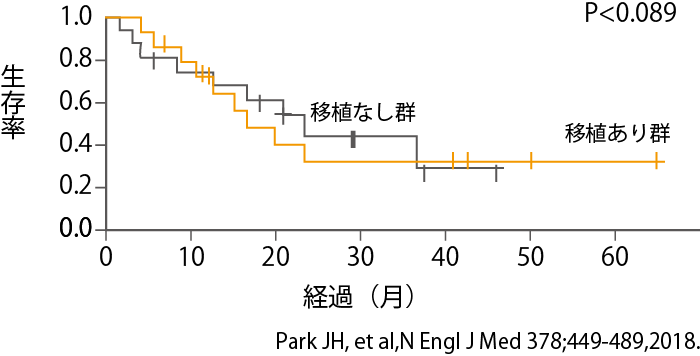
再発・難治性のB-ALLの治療は大変難しく、MSKCCの研究者はCAR-T療法だけで治癒が得られる可能性は低く、最後の詰めとして同種造血幹細胞移植を行う必要があると考えました。すなわち、CAR-T療法は良い条件で同種造血幹細胞移植に持ち込むためのつなぎ役と考えたわけです。
そこで、MSKCCでは、CAR-T療法によって深い完全寛解が得られた患者さん(微小残存病変なし)において、その後、造血幹細胞移植を行ったグループと行わなかったグループの比較を行いました。その結果、予想に反して、移植を行っても治療成績の改善は得られませんでした(図6)。この解釈としては、移植は患者さんにとっては大変負担の大きな治療法であるため、その影響が出たものと考えられます。
ただし、症例数も少なく、結論を出す段階ではないと思われます。CAR-T療法に加えて移植を行ったほうがよい患者さんと、CAR-T療法だけで良い治療経過が見込める患者さんの見極めができるようなバイオマーカーの開発も、今後の大きなテーマとなっています。
CAR-T療法の副作用
早期に現れる副作用で特に問題になるのは、サイトカイン放出症候群(CRS)です。主にT細胞の活性化に伴う高サイトカイン血症によるもので、症状としては発熱、低血圧、呼吸不全、頻呼吸、低酸素症などがあげられ、IL-6、IFN-γなど炎症性サイトカインの上昇が見られます。CAR-T細胞を輸注した後、数時間から10数日経ってから現れることが多いようです。
そもそもCAR-T療法はT細胞を活性化させるのが目的であるため、ある程度のCRSが出ないと効果も期待できないことになります。したがって、CAR-T療法の効果が得られない患者さんでは、CRSもほとんど認められません。CRSの多くは軽いものですが、重症になるとICU(集中治療室)での治療が必要となることもあるので、万全の対策が欠かせません。
CRSの治療には日本で開発された抗体薬のトシリズマブ(製品名:アクテムラ)が有効です。トシリズマブを使っても、体内のCAR-T細胞はそのまま生き残るので、CRSをコントロールしたあとも治療効果が期待できるという利点があります。トシリズマブで症状が緩和できない場合は、ステロイド薬で治療します。
神経毒性も早期に現れる副作用です。症状としては頭痛、意識障害、せん妄、幻覚、麻痺などがあげられます。多くは症状が軽く、自然に治りますが、まれに重篤になるケースもあります。治療は現在のところ対症療法しかありませんが、動物実験ではIL-1受容体のアンタゴニスト(拮抗薬)が有効であることが最近報告され、今後、臨床試験で効果と安全性が確かめられると思います。
早期の副作用としてはほかに腫瘍崩壊症候群があります。これはほかのがん治療でもみられますが、治療によって大量のがん細胞が死滅すると、高尿酸血症や高リン酸血症、低カルシウム血症、代謝性アシドーシス、高カリウム血症、腎不全、呼吸不全などの症状を来すものです。補液や薬剤の投与で予防・対処しますが、重篤な場合には血液透析などが必要になることがあります。
一方、後期に現れる副作用としては、CD19を発現する正常なB細胞も破壊されてしまうために起こる血清免疫グロブリンの減少があります。これに対しては補充療法が有効です。正常B細胞が一時的に減少したとしても、造血幹細胞が働いていずれは回復してくると考えらえています。
多発性骨髄腫に対するCAR-T療法
今後の検討課題の1つは、より効果を持続させるためのさらなる工夫です。そこで、免疫抑制作用のある制御性T細胞の働きを阻害する薬や、免疫チェックポイント阻害薬との併用についても検討され、研究が進められています。
さらに期待が寄せられているのは、CD19以外の標的抗原に対する新しいCAR-T療法の開発です。さまざまな研究が行われていますが、注目されているのは、BCMA(B細胞成熟抗原)という抗原を標的にした多発性骨髄腫に対するCAR-T療法です。骨髄腫細胞のほとんどはCD19陰性ですが、BCMAは骨髄腫細胞の60~70%に発現しているといわれているからです。
BCMAを標的とするCAR-T療法の臨床試験で良い成績を報告しているのが中国の企業です。再発・難治性の多発性骨髄腫の患者さん35人に対する第1相試験の結果によると、CAR-T療法を開始してから2か月以内に、35人中33人が部分奏効(VGPR)または完全奏効(CR)に達したという驚異的な治療成績でした。そればかりでなく、CAR-T療法を開始してから早い人で10日後にその効果が確認されるなど、治療効果が表れる速さも特筆に値するといいます。
現在、この中国の企業は西欧の製薬企業と共同でBCMA標的CAR-T療法を開発中で、日本を含む全世界での開発・製造・販売を計画しているということです。そのほか、別の米国企業もやはりBCMA-CAR-T療法の開発を進めており、日本でも臨床試験を開始するようです。
固形がんに対するCAR-T療法の可能性
現在のところCAR-T療法は、血液がんに対して顕著な治療成績を示していますが、がんの多くを占める固形がんに対しては、さまざまな研究が行われているものの、なかなか効果が得られていないのが現状です。
固形がんの場合、標的分子が不均一に存在したり、がん細胞が塊をつくるためCAR-T細胞による攻撃が難しいなどの問題があります。がん細胞が塊をつくっているとその中にT細胞が入っていきにくいのです。また、固形がんはがん細胞が増殖しやすい特殊な環境(がん微小環境と呼ばれています)を構築し、その中ではがんに対する免疫監視機構が抑制されやすいという問題もあります。
このため、固形がんに対してはCAR-T療法単独より、他の治療法を併用した複合療法が有効ではないかと研究が進んでいます。
そうしたなかで、日本では滑膜肉腫を対象とし、NY-ESO-1を標的としたTCR(T細胞受容体)-T細胞療法が注目されています。TCR-T 細胞療法とは、CAR-T細胞療法と同じ遺伝子改変T細胞療法の1つです。患者さんのT細胞を体外に取り出し、がん細胞を得意的に認識するTCRを発現させて増幅培養し、患者さんの体に戻すという治療です。現在、治験が行われており、承認が待たれています。固形がんに対しては、TCR-T細胞療法の方が標的抗原を見つけやすいかもしれません。
ユニバーサルCAR-Tなどの新しい取り組み
現在CAR-T療法で用いられているのは、患者さん自身のT細胞を使った「自家CAR-T」ですが、より安価で汎用性の高い「他家CAR-T」をつくる研究も進んでいます。近年、急速に普及しているゲノム編集技術を応用することにより、HLA(ヒト白血球抗原)のタイプにかかわらずだれにでも使えるユニバーサルのCAR-Tを作ろうというものです。
造血幹細胞移植などでは、本人以外の他家由来のリンパ球が患者さんの臓器を攻撃するGVHD(移植片対宿主病)がよく起こります。そこで、GVHDが起こらないようにするためにTCRを破壊しておいたり、HLAの違いにより拒絶反応が起こらないよう特定の遺伝子を破壊しておくなど、さまざまな工夫がされています。実際、移植をしてもMRD(微小残存病変)陽性で白血病細胞が残っていた患者さんにユニバーサルCAR-T療法を行ったところ、MRD陰性になり、その後再び移植を行ったところ良好な経過を得ている症例が報告されています。
CAR-T療法と免疫チェックポイント阻害薬との併用療法の臨床試験が海外で行われていますが、同様の目的でゲノム編集技術の応用が検討されています。がん細胞が発現するPD-L1がT細胞のPD-1と結合するとT細胞の働きにブレーキがかかり、がん細胞を攻撃しなくなります。そこで、免疫チェックポイント阻害薬によりT細胞へのブレーキを解除したうえでCAR-T療法を行うのが、この併用療法です。しかし、ブレーキ解除のためニボルマブ(製品名:オプジーボ)など抗体薬を用いると、がんを攻撃するだけでなく全身の免疫系が賦活されて深刻な副作用があらわれる場合があります。そこで、ゲノム編集によってCAR-T細胞のPD-1遺伝子だけを破壊しておきます。そうすると、PD-1/PD-L1経路のブレーキ解除はCAR-T細胞のみに限られるため、全身への影響を回避できるのです。この研究開発も中国が積極的に行っています。
ちなみに、CAR-T療法については世界中で研究開発が取り組まれ、さまざまな臨床試験が行われていますが、急激な勢いで研究開発を進めているのが中国です。2016年ぐらいまでは米国がトップを走っていたものの、現在は中国の勢いが勝っていて、2018年10月現在では、世界中で行われているCAR-T療法の400の試験を国別の実施数で見ると、トップは中国の169、続いて米国の134、ヨーロッパの62です。日本は南米やアフリカと同じでわずか4しかなく、日本の研究開発の立ち遅れが指摘されています。
CAR-T療法の費用と課題
CAR-T療法の課題としてもう1つ見逃せないものがあります。それは薬価です。
2017年8月、米国で世界初のCAR-T療法薬として承認されたキムリアは、1回の投与に日本円で5400万円ときわめて高額な価格となり、世界中の話題となりました。その後に承認されたイエスカルタも米国での価格は4200万円です。これほど高額になるのは、遺伝子操作などの細胞調製や知財関係でコストがかかるためです。ただし、米国では「アウトカム(結果)アプローチ」の仕組みがあり、5400万円の投与費用は効果があった場合にのみ請求されることになっています。
日本には「アウトカムアプローチ」の仕組みはないため、効果にかかわらず費用を支払う必要がありますが、保険適用になれば「高額療養費制度」により自己負担限度額を超えた分は払い戻されます。しかし、患者さん個人の負担は軽減されたとしても、1人の患者さんに対する1回の治療で5000万円もの費用がかかるとなると国の医療経済にとっては大きな問題となるでしょう。このため、今後はこうした新しい治療法の医療費のあり方をどうすべきかという議論が必要となり、各製薬企業にとってもコスト削減が大きな課題となります。
その意味では、コストを下げてより安価にするためのユニバーサルCAR-T療法の開発が大いに待たれるところです。また、名古屋大学では、比較的安価な方法として、ウイルスベクターを使わない遺伝子改変によってCAR-T細胞を作る方法を開発し、2018年1月から臨床試験を開始しています。
有効な治療法を待つ患者さんの切実な思いに応えるためのさまざまな努力や工夫に期待したいものです。
プロフィール
小澤敬也(おざわ・けいや)
1984年 東京大学医学部第3内科助手
1985年 米国国立衛生研究所(NIH)に留学
1987年 東京大学医科学研究所病態薬理研究部講師
1990年 東京大学医科学研究所病態薬理研究部助教授
1994年 自治医科大学血液医学研究部門教授
1998年 自治医科大学血液学講座主任教授、分子病態治療研究センター遺伝子治療研究部教授(兼務)
2008年 自治医科大学分子病態治療研究センターセンター長(併任)
2011年 自治医科大学免疫遺伝子細胞治療学(タカラバイオ)講座教授(兼務)
2014年 東京大学医科学研究所附属病院長、先端医療研究センター遺伝子治療開発分野教授、遺伝子・細胞治療センターセンター長、自治医科大学客員教授
2018年 自治医科大学名誉教授・客員教授、免疫遺伝子細胞治療学(タカラバイオ)講座(責任者)

