NKT細胞標的がん治療とは―新しい免疫療法の臨床試験と期待

2019.3 取材・文:柄川昭彦
新しい免疫治療の開発が進んでいます。この治療は、1986年に発見され「第4のリンパ球」と呼ばれるNKT細胞(ナチュラルキラーT細胞)を活用するところがポイントです。がん組織では免疫抑制細胞などの働きにより、免疫が機能しない状態になっています。この治療は、体内のNKT細胞を活性化することにより、がん組織における免疫環境を一変させ、免疫細胞ががんを攻撃できるようにする治療法です。すでに臨床試験で有効性を示す結果が出ており、先進医療Bとして治療が行われてきた実績もあります。現在、NKT細胞を活性化させる新規リガンド(受容体に特異的に結合する物質)を用いた治療の第I相試験が進行しており、結果が注目されています。
がんと免疫-免疫が機能しない理由
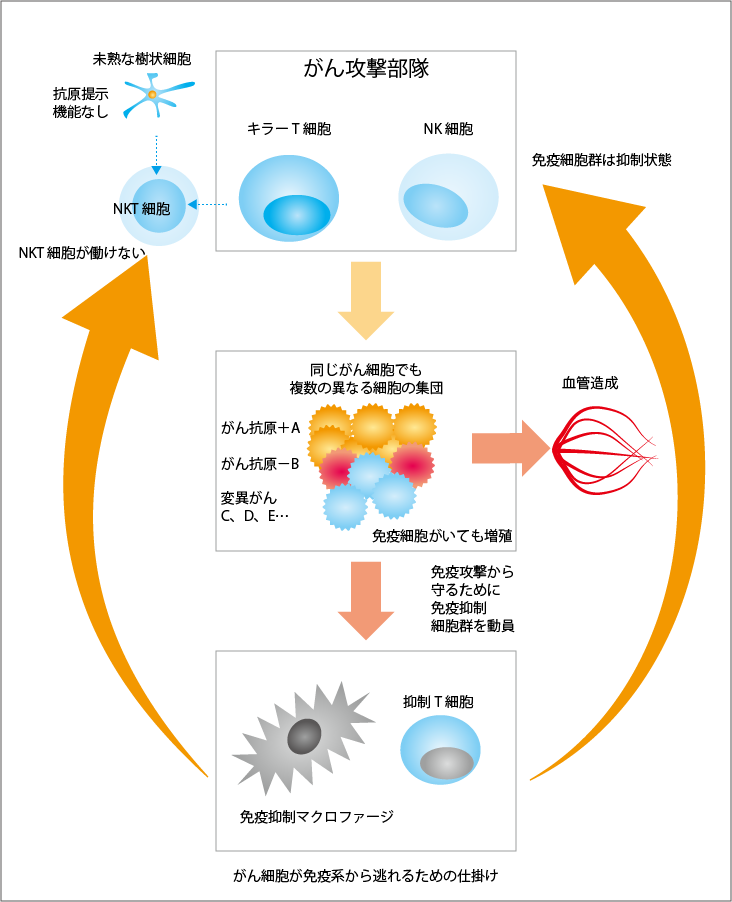
人間の体には、体にとっての異物を攻撃する免疫というシステムが備わっています。そのため、たとえ風邪をひいても、侵入してきた細菌などは免疫の働きによって排除され、1週間もすれば風邪は治ります。ところが、がんに対しては免疫が同じようには働きません。体内でがん細胞が増殖を始めると、免疫の力で死滅させることができなくなります。なぜなら、がん細胞の集団であるがん組織の中は、免疫が機能しない免疫不全状態になっているからです(図1参照)。
がんはいくつもの方法を駆使して、免疫が機能しないようにしています。その1つに、分子レベルの免疫チェックポイントがあります。これは、免疫チェックポイント阻害薬の開発につながった機構で、もともとは免疫系が暴走して自分を攻撃することがないようにしている自己防御の仕組みを、がん細胞が利用して免疫細胞の攻撃にブレーキをかけるものです。このほか、がん細胞は免疫抑制マクロファージや抑制性T細胞といった免疫抑制細胞を作り出すこともしています。これらの細胞が存在すると、キラーT細胞やNK細胞(ナチュラルキラー細胞)といった攻撃部隊の免疫細胞が働けなくなります。攻撃部隊だけでなく、がんの目印であるがん抗原を提示して攻撃対象を教える樹状細胞も、免疫抑制細胞の作用によって成熟できないため、本来の働きをしなくなります。最も致命的なことは、病原体に対して必ずできる長期免疫記憶が、がん細胞に対してはできないことです。こうした状況によって、NKT細胞も働けなくなります。NKT細胞の働きについては後で詳しく説明しますが、この細胞が働かないことで、免疫は本来の機能を発揮できなくなっているのです。
試験管内にがん細胞を入れ、そこに攻撃部隊となるリンパ球を加えると、時間はかかりますが、がん細胞は徐々に死んでいきます。しかし、たくさんのリンパ球があっても、がん細胞がすべて死滅することはなく、一部が生き残ります。また、がん細胞が増殖するときに変異を起こし、新しいがん細胞も生まれてきます。がん組織には1種類のがん細胞が集まっているわけではなく、複数の異なる種類のがん細胞で構成されることになります。そのため、すべてのがん細胞を死滅させることは困難なのです。
従来、がんの免疫療法として、攻撃部隊となる免疫細胞を体外で培養し、数を増やしてから体に戻す治療が行われてきました。しかし、この方法では十分な効果は得られません。がん細胞の生き残りや変異が体内で起こるため、がん細胞をすべて死滅させることができないからです。また、体に戻した免疫細胞攻撃部隊は48時間以内に死んでしまうため、たとえそのときに攻撃できたとしても、効果は持続しません。さらに、培養した免疫細胞はがん組織への目印を失ってしまうことがあり、多くはがん組織に到達できません。到達したとしても、がん組織は免疫不全状態になっていて、本来の力を発揮できないのです。そういったさまざまな問題があり、体外で培養した免疫細胞を投与しても、十分な治療効果は現れなかったのです。
こういった問題を解決してくれる新しい免疫治療が、現在私たちが研究開発を行っている「NKT細胞標的がん治療」です。
NKT細胞が免疫に果たす役割
NKT細胞について、簡単に説明しておきましょう。この細胞は、T細胞、B細胞、NK細胞に続く「第4のリンパ球」と呼ばれている免疫細胞です。私が千葉大学に在籍していた1986年に発見しました。
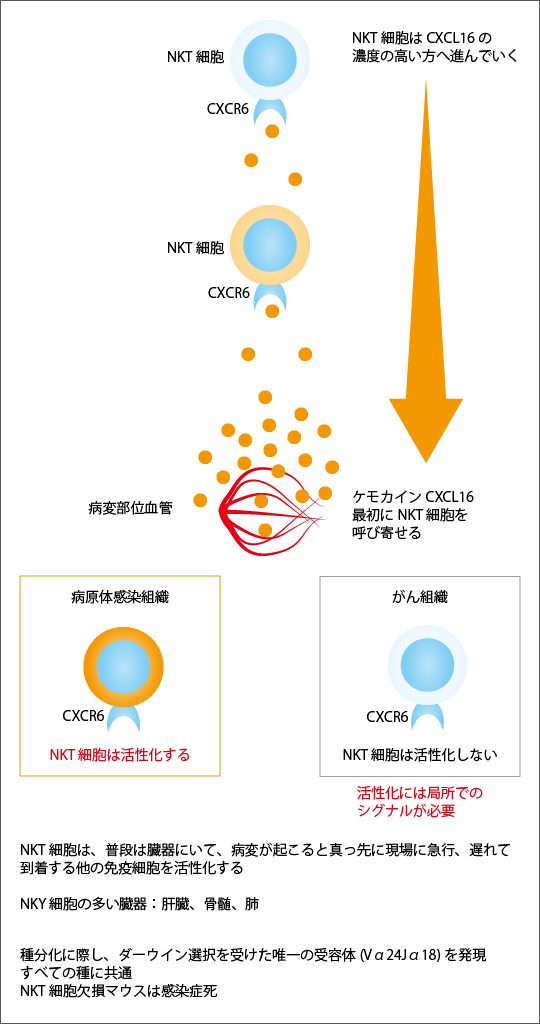
末梢血中にNKT細胞は非常に少なく、末梢血の白血球の中の0.1~0.01%を占めるにすぎません。普通のリンパ球はリンパ節に多いのですが、NKT細胞はリンパ節にもおらず、普段は肝臓、骨髄、肺に集まっています。そして、病変が生じるとすぐに現場にやってきます。病変部からNKT細胞を呼び寄せる「CXCL16」という物質が、血液中に放出されるためです(図2参照)。すると、肝臓や骨髄、肺にいたNKT細胞は、その物質の濃度が高いほうへと進んでいき、真っ先に病変部にたどり着きます。
その病変が細菌などの病原体による感染だった場合には、病変部に到着したNKT細胞はすぐに活性化されます。病原体からNKT細胞を活性化する物質が出ているためです。そして活性化したNKT細胞は、免疫にかかわる重要な役割を果たします。その1つが、攻撃役の免疫細胞を活性化して急速に増殖させるアジュバント作用です。
体に異物が侵入したとき、その異物の抗原に対応する受容体をもつ免疫細胞が反応します。するとNKT細胞は、その免疫細胞を活性化し、1つの細胞を数十億個にまで一気に増殖させ、免疫細胞の軍団を作り上げます。それによって、免疫は病原体に打ち勝つことができます。風邪が1週間ほどで治るのも、こうした免疫の働きがあるからなのです。つまり、体が病原体に負けないためには、NKT細胞のアジュバント作用が必要なのです。
そして、一度活性化して軍団を作った免疫細胞は、その病原体に対する長期免疫記憶を保持するため、再びその異物が体内に侵入してきたときは、すぐに撃退することができます。こうした免疫の記憶を利用したのがワクチンです。したがって、ワクチンを作るのには、NKT細胞を活性化することが欠かせません。NKT細胞の活性化が起こらないと免疫の記憶ができないからです。
NKT細胞が普通の免疫細胞と異なる点は、抗原を認識する受容体が1つしかない点です。動物が進化する過程において生じた多くの変異の中で、環境に適応するためにある変異だけが残ることを「ダーウィン選択」といいます。NKT細胞の受容体は、免疫細胞の抗原受容体の中でダーウィン選択を受けた唯一の受容体であることを発見しました。その意味するところは、このNKT細胞、すなわちNKT細胞がこの受容体を介して活性化されることが、動物が生きていくために欠かせないものであることを示しており、実際、NKT細胞を欠損したマウスやヒトでもX染色体連鎖リンパ球増多症(XLP症候群)患者は、普段我々が感染しても問題ないような病原体の感染により、100%死に至ることがわかっています。
こんなに重要な働きをするNKT細胞ですが、そのままでは、がんに対しては十分な働きをすることができません。がん細胞は自己の正常細胞からできたものなので、NKT細胞を活性化する分子がないからです。そのため、NKT細胞は優れた潜在能力をもちながら、そのままではがんに対しては役に立ちません。がんの治療にNKT細胞を利用するためには、人工的にNKT細胞を活性化する必要があるのです。
NKT細胞のがんに対する働き
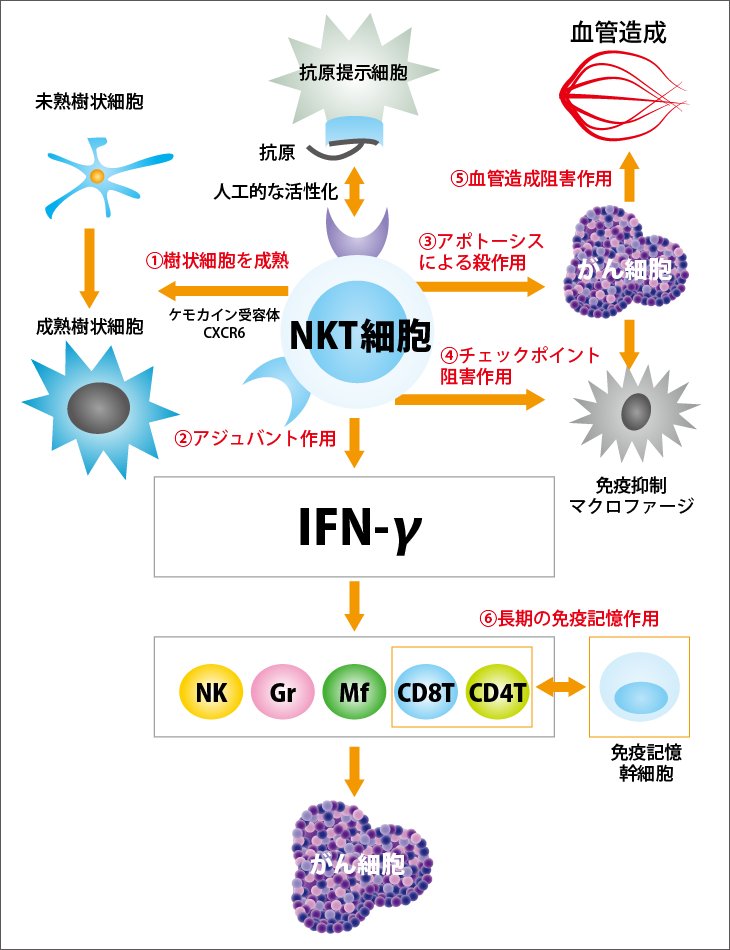
人工的に活性化したNKT細胞はがんに対してどのように働くのでしょうか。次のような6つの働きがあります(図3参照)。
(1)樹状細胞を成熟させる働き
樹状細胞は、攻撃部隊を構成する免疫細胞に、がんの目印であるがん抗原を提示する役割を担っています。それにより、提示したがん抗原に合う受容体をもった働き蜂とも言えるキラーT細胞を増やし、がんを攻撃させるのです。こうした働きは、成熟した樹状細胞でなければできません。がん組織では、がんが作る免疫抑制細胞や免疫抑制物質の働きで樹状細胞は成熟できなくなっていますが、人工活性化NKT細胞は樹状細胞を成熟させることができます。
(2)アジュバント作用
活性化NKT細胞は、IFN-ɤ(インターフェロン・ガンマ)という物質を出し、さまざまな免疫細胞を次々に増殖させる働きをします。キラーT細胞、NK細胞、マクロファージを活性化し、それらを増殖させてがんに立ち向かうようになります。
(3)アポトーシスによるがん細胞に対する直接殺作用
活性化NKT細胞は、がん細胞を直接殺す働きももっています。ただし、活性化NKT細胞を腫瘍内に直接注入する場合は別にして、通常は、NKT細胞は数が少ないので、がん細胞を殺す働きは、攻撃部隊を形成する他の免疫細胞ほど大きくはありません。
(4)チェックポイント阻害作用
活性化NKT細胞は、がん細胞が生体の免疫細胞の攻撃から自身を守るために用意した免疫抑制細胞を殺す働きをします。それによって、さまざまな免疫抑制が解除され、がん組織内の免疫の状態が大きく向上します。
(5)血管造成阻害作用
がんは増殖に必要な栄養と酸素を得るため、がん組織に向けて新たな血管を造成しますが、活性化NKT細胞の働きで、がん組織内の免疫環境が改善され、免疫細胞の攻撃が活性化される結果、この血管造成も抑えられます。
(6)長期の免疫記憶作用
がん細胞にはNKT細胞を活性化する物質がないため、病原体感染のときのように免疫記憶を作ることができません。がんに対する免疫記憶を作るには、生体内のNKT細胞を人工的に活性化することが必須です。人工的に活性化されたNKT細胞は、がんに対する免疫記憶幹細胞を作り、長期間がんを攻撃できる免疫記憶誘導することができます。
NKT細胞を標的にしたがん治療
こうした人工活性化NKT細胞だけがもつ6つの作用をがんの治療に利用するのが、「NKT細胞標的がん治療」です。これまでの免疫療法とはまったく違う治療法だと言えます。これまでの治療法は、がんを標的として、それを攻撃する免疫細胞を増やすという戦略でした。NKT細胞標的がん治療では、標的となるのは、がんでは活性化が期待されないNKT細胞です。それを人工的に活性化し、活性化NKT細胞とすることで、前述した1~6のような作用が発揮されます。すると、がん組織内の免疫状態ががらりと変わり、免疫細胞ががんを攻撃するようになるのです。また、免疫記憶が残るため、がんが増えた場合には、働き蜂ともいえるキラーT細胞がいつでもすぐに補給されます。そのため、がんの進行も再発も転移も抑制されます。
NKT細胞標的がん治療は、女王蜂戦略によるがん治療といえます。48時間以内に死んでしまう働き蜂を増やして体内に入れても、1回攻撃するだけで終わってしまいます。これに対し、女王蜂ともいえるNKT細胞を活性化することで、免疫の環境を変え、どんどん働き蜂を供給でき、長期間免疫記憶を作るようにするのが、この治療法の特徴です。
NKT細胞標的がん治療が適さない人がいます。1つは自己免疫疾患の患者さんです。自己免疫を起こすリンパ球を活性化することになり、自己免疫疾患が悪化する危険性があります。また、B型肝炎とC型肝炎の患者さんも、基本的に適していませんが、C型肝炎の既往があっても肝炎治療によってウイルスが排除されている人や、B型肝炎でも抗体陽性の人は受けられます。妊娠中の人も受けられません。流産の危険があるためです。
NKT細胞を活性化する物質を発見
前述したように、NKT細胞を発見したのは1986年のことです。NKT細胞は感染防御に欠かせない免疫細胞で、長期免疫記憶にかかわっていることも明らかにできました。米国免疫学会は、NKT細胞の発見を「免疫の金字塔(Pillars of Immunology)」として認定しています。
そして1997年には、NKT細胞を人工的に活性化するリガンド(NKT細胞受容体に特異的に結合し活性化する物質)が、糖脂質の「αGalCer」(アルファ・ガラクトシルセラミド)であることを突き止めました。これを使うことで、NKT細胞を人工的に活性化することができるようになりました。具体的には、患者さんの血液から採取した血液細胞を培養することで樹状細胞を作り、それにαGalCerを取り込ませ、αGalCerを提示するようになった樹状細胞を細胞製品として患者さんに投与することで、体内のNKT細胞を人工的に活性化できます。患者さんの体内の免疫環境を大きく変えて、がんの治療に応用するのです。
治療効果を確認するため、まず動物実験が行われました。がん抗原ワクチンだけ投与しても、がんを殺すキラーT細胞はあまり増えませんが、がん抗原ワクチン投与と同時にNKT細胞を人工的に活性化させると、キラーT細胞が30倍にも増えることがわかったのです。そして、このような状況になると、がんの増殖も止まることがわかりました。
次に臨床的治療効果を調べるための動物実験を行いました。肝臓にメラノーマ(悪性黒色腫)が転移しているマウスを対象とし、これを2群に分けます。そして、一方にはNKT細胞を人工的に活性化する細胞製品を投与し、もう一方は対照群として無治療としました。その結果、1週間後には、対照群のマウスの肝臓全体ががんで埋め尽くされるほどメラノーマの転移巣が増大していましたが、治療群のマウスの肝臓では、メラノーマがきれいに消えていました。動物実験でも、治療効果が期待できるような結果が得られたのです。
NKT細胞標的がん治療の臨床試験
これらの動物実験結果をもとに、ヒトに対する臨床試験が行われました。治療の流れは次のようになります。
まず、がん患者さんから採血します。アフェレーシスという方法で、単核球という核がある細胞だけを採り出し、赤血球、血小板、血漿などは患者さんの体に戻します。そして、採り出した細胞をクリーンルームで培養し、樹状細胞を成熟させて、そこにαGalCerを加えて培養し、αGalCerを提示するようにします。これが細胞製品となります。この細胞製品を患者さんに投与すると、がん患者さんの体内でNKT細胞が活性化され、前述したような6つの作用が発揮されるようになります。
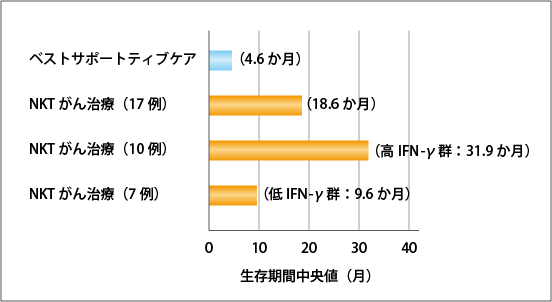
最初の臨床試験は千葉大学で行われました。対象となったのは、進行・再発非小細胞肺がん(ステージIIIB、ステージIV、再発)の患者さん17人です。手術、放射線治療、化学療法に対して効果がなかった人たちで、通常、こうした状態の患者さんは緩和ケア中心の治療が行われ、平均的な生存期間は4.6か月とされていました。
こうした患者さんたちにNKT細胞標的がん治療を行ったところ、その生存期間中央値は18.6か月でした(図4参照)。細胞製品を投与したのは1クール(投与細胞数が多いため、4週間隔で2回ずつ、合計4回の投与)だけで、それ以外の積極的治療はしていないのですが、それだけで生存期間が4.3倍に延長したことになります。
この17人をNKT細胞のアジュバント作用を担うIFN-ɤ発現の高低によって「高IFN-ɤ群」と「低IFN-ɤ群」に分けて解析すると、高IFN-ɤ群の生存期間中央値は31.9か月で、低IFN-ɤ群は9.6か月でした。そして、高IFN-ɤ群では、治療から約1年半まで100%の患者さんが生存したのです(図5参照)。これは注目すべき結果で、たとえば1年ごとに細胞製品を投与すれば、長期生存が期待できるとも考えられます。
この臨床試験の結果から、NKT細胞標的がん治療は、「先進医療B」として認可されました。千葉大学では、2011年からは進行肺がん(進行・再発非小細胞肺がん)を対象に開始し、これらはすでに終了しています。さらに、千葉大学では2013年からは頭頸部がんを対象に、国立病院機構では、2014年からステージIIA~IIIAの術後肺がんを対象にした「先進医療B」が行われています。
千葉大学において2011年から先進医療Bで行った進行・再発非小細胞肺がん35例の治療成績をまとめると、生存期間中央値は22.2か月でした。最初の臨床試験と併せて考えても、1クールの治療で20か月前後の生存期間長期延長が期待できるといえそうです。
NKT細胞標的がん治療を行ったとき、患者さんの体内でどのようなことが起きているのかも調べました。まず、腫瘍組織の中に活性化NKT細胞が集まってきて、正常組織の25~60倍になっていました。また、普段は免疫抑制状態にある腫瘍組織内でも活性化NKT細胞の働きで、アジュバント作用にかかわるIFN-ɤも増え、それによってさまざまな免疫細胞が次々に活性化され、増えていることがわかりました。つまり、この治療はNKT細胞を標的にし、それを活性化することで、がん組織内の免疫不全状態を改善していることが確かめられたのです。
(Motohashi S, et al. J. Immunol, 182: 2492, 2009)
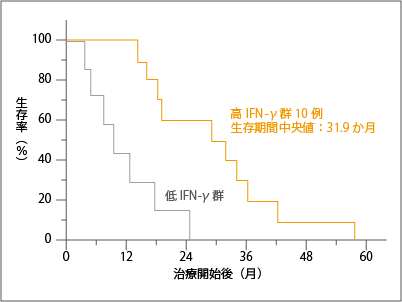
(Motohashi S, et al. J. Immunol, 182: 2492, 2009)
免疫治療の効果判定の考え方
NKT細胞標的がん治療は、このように臨床試験、および先進医療Bも行われ、治療効果を確認することができましたが、その評価判定において従来の効果判定基準を用いることは必ずしも正しくないことがわかりました。すなわち、免疫治療の場合、がん治療効果を判定するのに、従来抗がん剤で使用されていた評価基準であるRECIST(Response Evaluation Criteria in Solid Tumors)は、適切ではない場合があるということです。RECIST判定では、治療によってがんの大きさがどう変化するかで、CR(完全奏効)、PR(部分奏効)、SD(安定)、PD(進行)を判定します。がんが小さくなれば治療効果が優れている、がんが小さくならなければ治療効果が劣っているという判定方法なのです。
千葉大学で行った臨床試験において、31.9か月という長期生存が得られた10例(生存期間中央値が31.9か月)についてRECIST判定を行ってみると、10例中の6例がPDで、4例がSDでした(図6参照)。つまり、がんが小さくならなくても、治療がよく効いて長期生存が得られた症例の割合が高いのです。免疫治療ではこうしたことがよく起こり、従来のRECIST判定では免疫治療の効果が過小評価される可能性があることに注意が必要です。
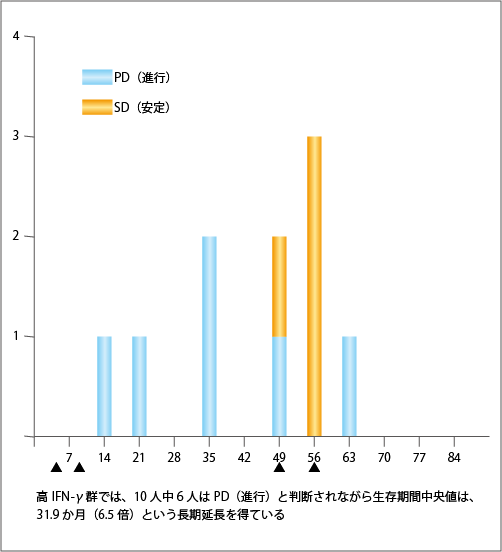
転移や再発を抑える長期の免疫記憶
もう1つ重要なのは、NKT細胞標的がん治療が長期の免疫記憶を作り出している点です。動物実験では、細胞製品を1回投与するだけでも、免疫記憶細胞が36週までいることが確かめられています。それによって、転移や再発が抑えられていると考えられています。
NKT細胞標的がん治療の長期免疫記憶を確認できた臨床試験結果もあります。この試験の対象となったのは、頭頸部粘膜悪性黒色腫の患者さん18例です。このがんに対して、放射線治療と化学療法を併用する治療が試されてきました。しかし、この治療を行っても、患者さんは次々と転移を起こし、治療後の経過に伴って生存率は低下していきます。ところが、化学療法の代わりにNKT細胞標的がん治療を併用した患者さんは、治療から2年が経過した時点で約88%の生存率を保ちました。そして、同じ治療を行って転移していない患者さんの割合も、同じように約88%を保ちました。つまり、NKT細胞標的がん治療を行うと、転移が抑えられるために命を落とさないということが明らかになったのです。これは、長期免疫記憶によって転移が抑制されることを証明した重要な臨床試験であるといえます。長期免疫記憶ができると転移が抑制され、それによって生存率が高まることが証明されたのです。
がん患者さんにとって、がんの再発・転移がないことが極めて重要で、NKT細胞標的がん治療は、長期免疫記憶を作るために重要です。そして、このがんの再発・転移を抑制するためには、免疫記憶の維持が必要で、そのためには、投与は1回で十分とはいえません。免疫記憶の長さは、病原体ワクチン効果が数十年にわたるものもあれば、数週間しかもたないものもあるので、がんの種類によって異なる可能性がありますが、どのような長さだったとしても、複数回投与することによって、長期生存が得られる可能性があります。
細胞製品を複数回投与することを考えると、その細胞製品は患者さん自身から採取した細胞で作るのが理想的です。他人の細胞から作った細胞製品を複数回投与すると、アナフィラキシーショックを引き起こす危険性があります。実際、米国では2008年、他人の細胞から作った前立腺がんの細胞治療薬「GBAX」の開発治験実施中に、副作用による死亡例が多かったことから、お薬を認可する米国FDAが使用中止を勧告しています。他人の細胞で作る細胞製品には危険がつきまといますが、自分の細胞から作った細胞製品なら安全です。
新規リガンドでの臨床試験
私は、千葉大学から理化学研究所に移ったあとも、この研究を続け、その過程で、2つの新しい発見をしました。αGalCerに代わる新規リガンドおよび樹状細胞とは異なる糖脂質専門の抗原提示細胞を発見しました。この2つを組み合わせて細胞製品を開発し、現在、慶応大学病院において、NKT細胞標的がん治療薬事開発のための治験が始まっています。「新規リガンドを用いたNKT細胞標的がん治療」というプロジェクト名の第Ⅰ相医師主導治験です。
千葉大学で行った臨床試験では、NKT細胞を活性化するリガンド物質として、糖脂質のαGalCerを使用していました。今回の新たな臨床試験では、αGalCerに代わる新規リガンドを使用しています。この新規リガンドは、理化学研究所において合成された172種類ものαGalCer誘導体の中から、NKT細胞を活性化する能力が最も高い物質として選び出されたものです。αGalCerに比べ、約40倍も活性化能が高いことがわかっています。
また、以前の方法では細胞製品が完成するまでの培養期間に10日がかかりましたが、新たに見つかった糖脂質専門の抗原提示細胞と新規リガンドを使用することで、培養期間が2日間に短縮されています。製造期間の大幅な短縮は、細胞医薬品を製造する場合のコストを減らすことに貢献します。完成した細胞製品は、4週間隔で2回、点滴で静脈内に投与します。
治験の対象となるのは、標準治療が無効となった進行・再発固形がんの患者さん(20歳以上75歳未満)で、がん種は特に決められていません。がん種を特定しないのは、患者さんの免疫系を標的とするNKT細胞標的がん治療は、すべてのがん種に効果が期待できると考えられるためです。
治験は2021年3月に終了する予定になっています。第I相試験であるため、安全性を確認することが主要評価項目となりますが、治験と同時にスタートする付随臨床研究で観察する項目で有効性が示された場合には、再生医療等製品として条件および期限付き承認の取得も目指しています。
プロフィール
谷口 克(たにぐち・まさる)
1976年 オーストラリア、メルボルンのウォルター&エリザ・ホール医学研究所留学
1980年 千葉大学医学部免疫学教授
1986年 NKT細胞を発見
1996年 千葉大学医学部部長
1997年 日本免疫学会会長
2001年 理化学研究所免疫アレルギー科学総合研究センターセンター長
2013年 理化学研究所統合生命医科学研究センター特別顧問兼グループディレクター
2018年 理化学研究所科技ハブ産連本部創薬・医療技術プログラム臨床開発支援室客員主管研究員

