前立腺がんの治療
前立腺がんのステージ分類やリスク分類による、治療選択と治療法を解説します。
前立腺がんの治療選択
前立腺がんは、「限局性(局所進行性含む)」「転移性去勢感受性」「非転移性去勢抵抗性」で初期治療の選択が異なります。
限局性・局所進行性前立腺がんの治療選択
限局性の場合、PSA値、がんの悪性度、進展度を総合的に判定し、「超低リスク」「低リスク」「中間リスク」「高リスク」に分類し治療法が決定されます。
NCCNガイドラインでは、「期待余命20年以上の超低リスク」「期待余命10年以上の低リスク」「予後良好の中間リスク」の患者さんに対して、監視療法が推奨されています。予後良好の中間リスクの患者さんでは、悪性度の高い場合があるため、密なフォローアップを行うことが提案されています。
低~中間リスクの前立腺の一部に限局する患者さんは、Focal therapyの対象となりますが、対象となる患者さんの選択基準においては、がん病巣の限局性および病巣診断を厳密に行うことが必須とされています。
超低リスク~局所進行性前立腺がんの患者さんでは、「前立腺全摘除術」「放射線治療(外照射)」「放射線治療(永久挿入密封小線源療法)「放射線治療(高線量率組織内照射)が治療選択となります。特に、局所進行性や高リスク前立腺がんの一次治療として、前立腺全摘除術とホルモン療法併用放射線治療の優劣はまだ明らかとなっていないため、患者さんの状態や状況、希望などを考慮して選択されます。
期待余命が10年以下の低~局所進行性の場合は、ホルモン療法が治療選択となります。

出典:日本泌尿器学会編.前立腺癌診療ガイドライン2023年.限局性・局所進行性前立腺癌の治療アルゴリズムより作成成
転移性去勢感受性前立腺がんの治療選択
転移性去勢感受性の前立腺がんに対しては、新規アンドロゲン受容体シグナル阻害薬とドセタキセルの適切性を総合的に検討した上で、治療選択が行われます。新規アンドロゲン受容体シグナル阻害薬とドセタキセルによる治療が「適切」と判定された高リスクの患者さんに対しては、一次治療としてアンドロゲン遮断療法+新規アンドロゲン受容体シグナル阻害薬(アビラテロン、アパルタミド、エンザルタミド)が選択されます。さらに、「適切」と判定された低リスクの患者さんに対しては、アンドロゲン遮断療法+新規アンドロゲン受容体シグナル阻害薬(アパルタミド、エンザルタミド)が選択されます。
アンドロゲン遮断療法+ダロルタミド+ドセタキセルの3剤併用療法とアンドロゲン遮断療法+ドセタキセルを比較した臨床試験で、3剤併用療法の全生存期間の延長が示され、保険適用となっていますが、まだ実臨床のデータが十分ではないため今後の治療成績の解析が必要とされています。
新規アンドロゲン受容体シグナル阻害薬とドセタキセルによる治療が「不適切」と判定された場合は、アンドロゲン遮断療法が推奨され、複合アンドロゲン遮断療法も治療選択の1つとして考慮されます。 低腫瘍量の場合は、前立腺局所への外照射による放射線治療も考慮されます。
増悪が認められた場合は、転移性去勢抵抗性前立腺がんに対する治療が選択されます。
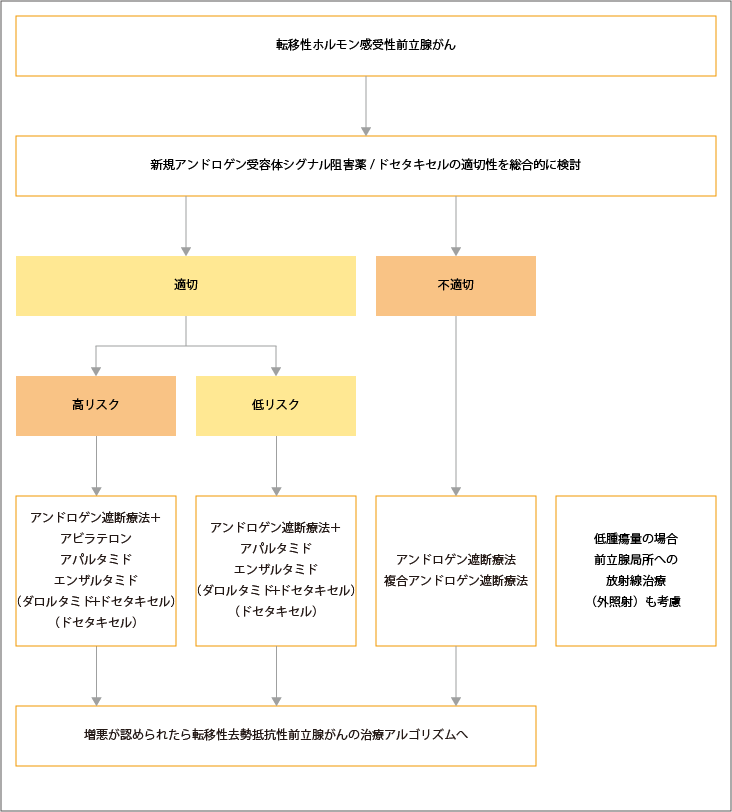
出典:日本泌尿器学会編.前立腺癌診療ガイドライン2023年. 転移性去勢感受性前立腺癌の治療選択の治療アルゴリズムより作成
非転移性去勢抵抗性前立腺がんの治療選択
アンドロゲン遮断療法中にPSA値の上昇が認められたものの画像検査による転移がない患者さんの病態を、非転移性去勢抵抗性前立腺がんといいます。非転移性去勢抵抗性前立腺がんには、2つのパターンがあります。1つは、手術や放射線治療による根治的治療後のPSA再発に対し、アンドロゲン遮断療法を行った後に病勢進行したパターン、もう1つは、根治治療なしでアンドロゲン遮断療法を行った後に病勢進行したパターンです。
非転移性去勢抵抗性前立腺がんとなった場合は、PSA-ダブリング・タイム(倍加時間)とPSA値を総合的に判断して治療が選択されます。PSA-ダブリング・タイムが10か月以下かつPSA値2ng/mL以上の場合は、アンドロゲン遮断療法+新規アンドロゲン受容体シグナル阻害薬(アパルタミド、エンザルタミド、ダロルタミド)が選択されます。PSAダブリング・タイムが10か月を超えるような場合でも、アンドロゲン除去症候群やビンテージホルモン剤の追加することで、病状が改善したようにみえることがあります。新規アンドロゲン受容体シグナル阻害薬が治療の主体となってきている現状では、ビンテージホルモン剤は使用されなくなってきています。また、病態によっては経過観察、もしくは初期治療で局所治療を行っていなければ、局所治療も考慮されます。
転移が認められた場合は、転移性去勢抵抗性前立腺がんに対する治療が選択されます。
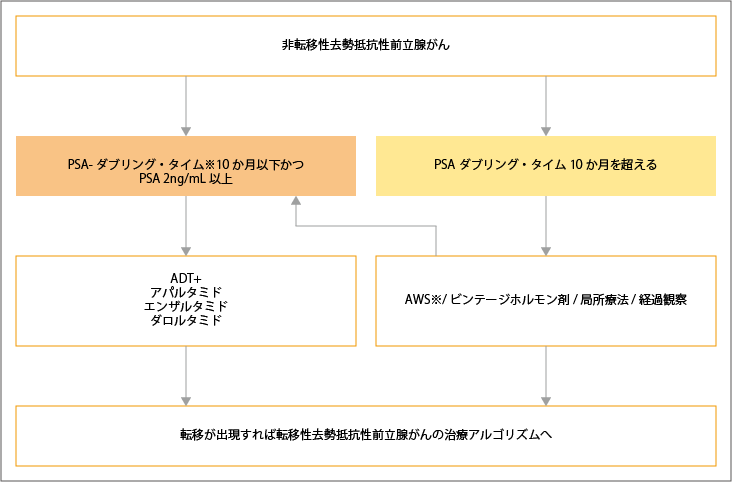
※PSA-ダブリング・タイムは、PSA値が倍になるまでの時間。
※AWS(アンドロゲン除去症候群)は、複合アンドロゲン遮断療法を一次治療として行っていた場合に、ピカルタミドやフルタミドといったビンテージホルモン剤を中止することで、PSA値の低下を認めるなど、一時的に病状が改善した状態です。
出典:日本泌尿器学会編.前立腺癌診療ガイドライン2023年. 非転移性去勢抵抗性前立腺癌の治療選択の治療アルゴリズムより作成
前立腺がんの監視療法
監視療法は、すぐに治療を開始する必要のない低リスクの患者さんに対し、定期的に検査を行っていくことをいいます。治療が必要と判断されれば、治療が開始されます。。
監視療法の適応の基準に関して、現在、各国でさまざまな研究が行われています。これらの研究で、監視療養の対象となっているのは、「比較的高齢」「限局性がん」「がんの悪性度が低い(グリソンスコアが6あるいは7程度)」「PSAが比較的低い(10ng/mL以下)」「臨床病期がT1~T2a程度」の患者さんです。。
監視療法における経過観察方法は、各国のガイドラインにより異なります。日本のガイドラインでは、3~6か月ごとの直腸診とPSA検査、1~3年ごとの前立腺生検です。再生検の結果、グリソンスコアの上昇または陽性コア数の増加、ステージの進行が認められた時が、治療開始の基準となります。
各国のガイドライン
| ガイドライン | ステージ | 生検前のMRI | グリソンスコア | 陽性コア数(本) | 最大陽性コア率(%) | PSA(ng/mL) | PSA密度 | 備考 |
| NCCNガイドライン | T1C | ー | 3+3 | 3以下 | 50以下 | 10以下 | 0.15未満 | 超低リスク:期待余命20年以上 |
| T2a以下 | ー | 3+3 | ー | ー | 11以下 | ー | 低リスク:期待余命10年以上 | |
| 下記全てを満たす ・中間リスク ・グレードグループ1または2 陽性コア本数の割合50%未満 ※中間リスク因子T2b~2c、グレードグループ2または3、PSA10~20ng/mL | 予後良好中間リスク:期待余命10年以上 | |||||||
| EAUガイドライン | T2a以下 | 〇ー | 3+3 | ー | ー | 10以下 | 0.15未満 | 低リスク:期待余命10年以上(篩状※、管内がん除く) |
| T2a以下 | ー | 3+4 | 3以下 | 50以下 | 10以下 | ー | 中間リスク | |
| AUAガイドライン | T2a以下 | ー | 3+3 | ー | ー | 10未満 | ー | 低リスク |
| T2c以下 | ー | 3+3 | ー | 50以下 | 10~20 | ー | 中間リスク | |
| T2a以下 | ー | 3+4 | ー | 50以下 | 10以下 | ー | 中間リスク | |
| 前立腺癌診療ガイドライン2016年版 | T2以下 | ー | 3+3 | 2以下 | ー | 10以下 | 0.2未満 | 低リスク |
| 前立腺癌診療ガイドライン2023年版で追加 | T2以下 | ー | 3+4 | 2以下 | ー | 10以下 | 0.2未満 | 中間リスク:(篩状※、管内がん除く) |
※篩状(しじょう)とは、篩(ふるい)のように小さな丸い隙間が形成されている状態
出典:日本泌尿器学会編.前立腺癌診療ガイドライン2023年.総論6 監視療法 表1より作成
前立腺がんの手術
前立腺と精嚢を全摘する前立腺全摘術は、限局性・局所進行性の患者さんに対する根治を目的とした治療法の1つです。侵襲性が高く、術後の合併症に加え、尿失禁や勃起不全などの後遺症の可能性があるため、メリットとデメリットを十分に考慮したうえで行われます。手術方法は、開腹手術、腹腔鏡下手術、ロボット支援手術の3つの方法があり、治療効果は同じです。
開腹手術は、下腹部を切開する方法と会陰部を切開する方法があり、医師が病変に触れ確認できることがメリットですが、体への負担は大きい手術です。
腹腔鏡下手術は、数か所を小さく切開し、そこから手術道具を挿入して行われる手術です。道具を使って患部を拡大して見ることで、傷口が小さく出血も少なく済むため、回復が早いのがメリットです。
ロボット支援手術は、腹腔鏡下手術と同様に数か所を小さく切開し手術道具を挿入して行われますが、ロボット器具を使用するため手術器具の可動範囲が広く、狭い空間でより精密な手術が可能になります。
前立腺全摘術の術後には、尿失禁と勃起不全が起こる可能性がありますが、これらは患者さんの生活の質(QOL)を低下させる重要な合併症です。尿失禁の回復率はおよそ60~96%という報告があり、一定の割合で回復せず残りますが、尿道括約筋や神経の温存手術が、回復に有効とされています。また、ロボット支援手術は、開腹手術や腹腔鏡下手術より、術後の尿失禁の可能性が低いという報告や、術前から骨盤底筋体操を行うことで早期回復に有効という報告もあります。重度の尿失禁患者さんに対しては、人工尿道括約筋植込み術による治療が行われる場合もあります。
勃起不全は前立腺全摘術の直後から発症し徐々に回復していきますが、回復する患者さんは約6割弱であると示した欧米の報告があります。日本の報告では、術後5年後に完全回復している患者さんは32%でした。術前に勃起能があり、リスクが低い患者さんでは神経血管束(NVB)を温存するNVB温存手術が考慮されます。ロボット支援手術は、開腹手術や腹腔鏡下手術より、術後に勃起不全を起こしにくい可能性があるとする報告もあります。また、NVB温存手術後に、組織保護作用がある「PDE5阻害薬」を用いることが有効と、科学的根拠に基づいて示されていますが、投与方法など細かいことに関しては、まだ明らかになっていません。
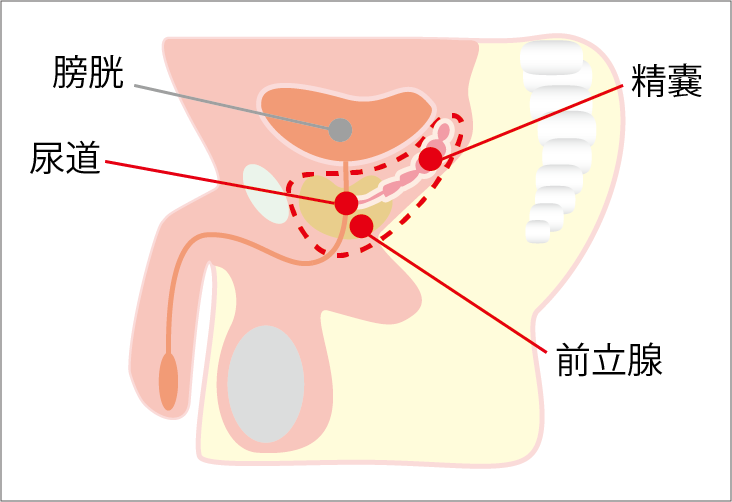
前立腺全摘術では、前立腺と精嚢、前立腺部分の尿道を切除したあと、尿道と膀胱をつなぎます
前立腺がんの放射線治療
放射線治療には、体の外側から放射線を照射する外照射と放射線を放出する物質を体内に入れ、内側から照射する内照射の2つの方法があります。いずれの方法も、放射線をがん細胞に照射することでがん細胞を攻撃しますが、周辺の正常な細胞にもダメージを与えるため副作用が起こることがあります。
外照射
外照射の種類
外照射による放射線治療は、技術の進歩により3次元原体照射(3D-CRT)、強度変調放射線治療(IMRT)、強度変調回転放射線治療(VMAT)、体幹部定位放射線療法(SBRT)など新たな治療法が開発されています。これらの治療に使われる放射線はX線ですが、炭素イオンを使用した重粒子線治療、水素の原子核(陽子)を使用した陽子線治療も放射線治療の1つです。
3D-CRTは、多方面方から3次元的に病変に放射線を照射する治療法です。IMRTやVMAT は、CT画像の情報を元に病変だけを狙い、周辺の正常組織になるべく放射線が当たらないように開発された治療法です。SBRTは、IMRTやVMATの技術により、いろいろな方向からピンポイントで照射することで1回の照射量を多くし、照射回数を少なくした治療法です。
重粒子線治療と陽子線治療は、放射線のエネルギーが到達する深さを調節することができるため、狙った部分に照射することができます。そのため、周辺の正常組織へのダメージが少なく、体への負担や副作用が少ないと考えられています。
放射線治療とホルモン療法の併用
放射線治療は、リスク分類に応じてホルモン療法と併用して行われます。低リスクの患者さんに対しては、治療効果は手術と同等のためホルモン療法の併用は推奨されません。中間リスクの患者さんに対しては、放射線治療前に4~6か月程度のホルモン療法が推奨され、高リスク患者さんに対しては、放射線治療後3年程度のホルモン療法が推奨されています。
放射線治療の副作用と対策
放射線治療は、照射線量の増加により治療効果は高くなりますが、副作用の発生リスクも高くなります。3か月以内に起こる急性副作用とそれ以降に起こる晩期副作用があり、主な副作用は、消化管障害、尿路障害、性機能障害です。
消化管障害のリスク因子は、高齢、直腸の容積が大きい、腹部手術の既往歴、糖尿病、痔、炎症性腸疾患の合併などです。一般的な治療が困難な直腸炎が起こった場合は高圧酸素療法※1、直腸出血ではアルゴンプラズマ止血術※2が考慮されます。
尿路障害は、起こってもおおよそ1年程度で解消され、2年後には治療前の状態に戻るとされています。外照射では、内照射の小線源療法と比べ発生頻度は低く、尿失禁やほかの重篤な尿路障害はまれです。治療前の尿路障害、経尿道的前立腺切除術、経尿道的膀胱腫瘍切除術の既往はリスク因子と考えられています。重症の放射性膀胱炎が起こった場合は、高圧酸素療法が考慮されます。
放射線治療による性機能障害は、前立腺全摘術とは異なり治療後すぐに起こりません。年齢、ホルモン療法の有無、治療前の勃起機能が重要な予測因子で、糖尿病はリスク因子と考えられています。血管が障害されたことで起こる勃起機能障害には、血栓を予防するPDE阻害薬が有効な可能性があります。
※1高圧酸素療法:通常の大気圧より高い気圧環境で、酸素を吸入することにより病態の改善を図る治療。
※2アルゴンプラズマ止血術:高周波電流をアルゴンガスとともに流し熱で表面を焼くことで止血する方法。
内照射
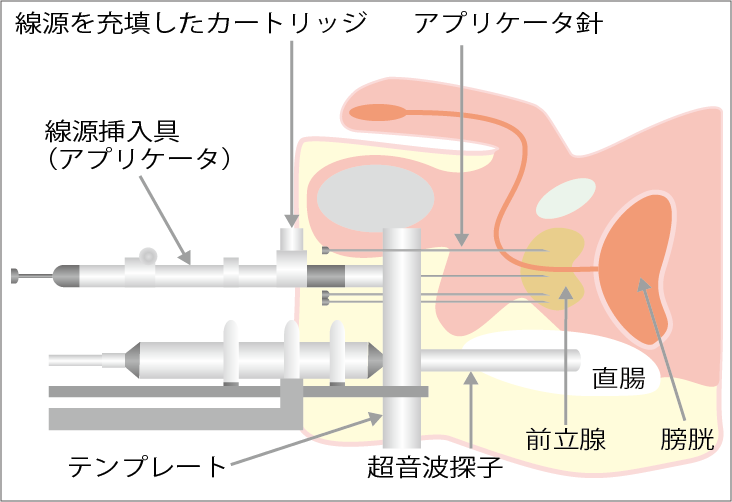
放射線の線源を体内に入れ照射する小線源療法には、低線量率ヨウ素125シード線源の「永久挿入密封小線源療法」と高線量率イリジウム192線源の「高線量率組織内照射」の2つがあります。
永久挿入密封小線源療法は、線源を永久的に前立腺内に留置する放射線療法です。低リスク患者さんでは、前立腺全摘術や外照射による放射線治療と効果は同等とされています。中間リスクや高リスクの患者さんに対しては、外照射やホルモン療法と併用することで有効とされ、特に高リスクの患者さんでは、この3つの治療法を併用することで良好な治療効果が期待されていますが、対象となる患者さんの明確な基準はありません。また、永久挿入密封小線源療法は、排尿障害や性機能障害のリスクが前立腺全摘術より低く、外照射と同等です。
高線量率組織内照射は、前立腺内に十数本の針を刺入し,遠隔操作式後充填装置を使いコンピュータで制御することでイリジウム192線源を前立腺内に短時間挿入して照射を行う治療法です。
前立腺がんのホルモン療法
前立腺がんは、精巣や副腎から分泌される男性ホルモン(アンドロゲン)の刺激により進行します。ホルモン療法は、薬剤で男性ホルモンを抑制し、がんの増殖を抑える治療です。
精巣は脳の下垂体から放出される黄体形成ホルモン(LH)の刺激を受け、男性ホルモンを放出します。下垂体は脳の視床下部から放出される黄体形成ホルモン放出ホルモン(LH-RH)が受容体と結合することでLHの分泌を刺激します。前立腺がんのホルモン療法では、LHを抑制するLH-RHアゴニストやLHとその受容体との結合を抑制するLH-RHアンタゴニストが使用されます。
また、男性ホルモンが前立腺の受容体(アンドロゲン受容体:AR)と結合することでがん細胞が刺激され増殖するため、男性ホルモンと受容体の結合を阻害する抗アンドロゲン薬による治療も行われます。
こうしたアンドロゲンの作用を抑制する治療をアンドロゲン遮断療法といいます。
ホルモン療法を長期間行うと、ホルモン療法に抵抗性となるがん細胞が増殖し効果がなくなることがあります。こうした状態を去勢抵抗性といいます。去勢抵抗性前立腺がんに対する新たな薬剤として開発されたのが、新規アンドロゲン受容体シグナル阻害薬です。2024年2月現在、アビラテロン、エンザルタミド、アパルタミド、ダロルタミドの4剤が承認されています。
前立腺がんの化学療法
前立腺がんに対する治療で使用される抗がん剤は、ドセタキセルとカバジタキセルの2剤です。ドセタキセルは、転移性去勢感受性前立腺がんで新規アンドロゲン受容体シグナル阻害薬とドセタキセルの投与が適切と判定された患者さんに対し、アンドロゲン遮断療法+ダロルタミド+ドセタキセルの3剤併用療法として使用されます。また、転移性去勢抵抗性前立腺がんの一次もしくは二次治療として単剤で使用されます。カバジタキセルは、ドセタキセル後に増悪した患者さんに対して使用されます。
前立腺がんのフォーカルセラピー
フォーカルセラピーは、できるだけ体に負担がかからないように、できるだけ前立腺内にある病変のみに対して行う治療法です。病変が残る可能性があるため、誰にでも行える治療ではありません。低~中間リスクの前立腺の一部に限局する患者さんでは、フォーカルセラピーの対象となりますが、対象となる患者さんの選択基準においては、がん病巣の限局性および病巣診断を厳密に行うことが必須とされています。
フォーカルセラピーは、「凍結療法」「高密度焦点式超音波療法(HIFU)」「小線源療法」「血管標的光線力学療法」「マイクロは凝固療法」などがありますが、このうち保険適用となっているのは、小線源療法だけです。
参考文献:日本泌尿器学会編.前立腺癌診療ガイドライン2023年.メディカルレビュー社

