多発性骨髄腫(MM)の正確な診断と予後予測に基づく治療

2018.9 取材・文:柄川昭彦
血液がんの治療に関する最新情報は、「血液がんを知る」をご参照ください。
多発性骨髄腫は抗体を作る形質細胞ががん化する病気で、高カルシウム血症、腎障害、貧血、骨病変などの症状が起きる病気です。かつては症状が現れてから治療を開始していましたが、現在はそれより早い段階で治療が始められるようになっています。自家造血幹細胞移植の適応があれば、移植が推奨されています。移植の適応がない場合には化学療法が行われます。多発性骨髄腫の治療薬は、9種類の新規薬剤が中心となっています。移植をするための前治療としての導入療法や、移植の適応がない場合の化学療法にも使われています。新規薬剤の登場により、多発性骨髄腫は長期間にわたって病気をコントロールすることが可能になっています。
多発性骨髄腫とは
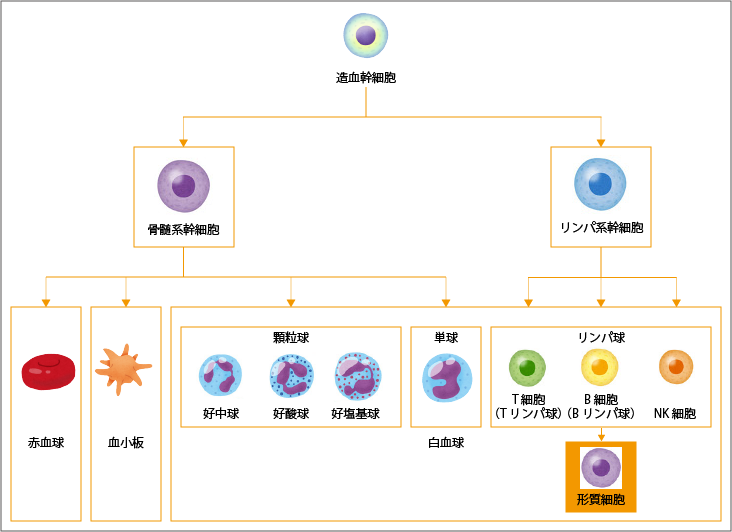
赤血球、血小板、白血球など血液を構成する細胞のうちの白血球の1つであるB細胞から分化して作られる形質細胞ががん化することで起こるのが、多発性骨髄腫という病気です。
形質細胞ががん化してできた骨髄腫細胞は、骨髄内で異常に増殖するため、正常な造血機能が抑えられてしまいます。そのため、赤血球が不足すると貧血が起き、白血球が不足すると感染症、血小板の不足は出血するなどのさまざまな症状が起きます。
形質細胞ががん化すると、細菌やウイルスなどから体を守るために形質細胞が作り出す正常な抗体が減少します。そのため、免疫の働きが低下してしまい、感染症を起こしやすくなります。また、がん化した形質細胞は、正常な抗体を作れなくなっただけでなく、Mたんぱくという異常なたんぱく質を作り出してしまいます。このMたんぱくが血液中に増加すると腎臓が障害されるので、腎臓機能の低下が起きるようになります。
また、がん化した形質細胞は、骨を溶かす破骨細胞の働きを活性化させます。さらに骨を作る骨芽細胞を抑える物質を作っていることもわかっています。そのため骨が弱くなり、骨折が起きやすくなります。また、骨が溶けるので、血液中のカルシウム値が上がります。
多発性骨髄腫によって引き起こされるこれらの症状を、高カルシウム血症(hyper Calcemia)、腎障害(Renal failure)、貧血(Anemia)、骨病変(Bone lesion)から4文字をとって「CRAB」といいます。
多発性骨髄腫は高齢者に多い病気なので、高齢者が増えている日本では増加しています。かつては人口10万人当たり3人ほどでしたが、現在は10万人あたり5人以上になっています。
多発性骨髄腫の検査と診断
多発性骨髄腫を発見するのに有効な検査は、血液検査と画像検査です。血液検査で、高カルシウム血症、腎機能の低下、貧血、総たんぱくの上昇、アルブミン値の低下などがあれば、多発性骨髄腫の可能性があります。画像検査では骨折の有無を調べます。大きな骨折はX線撮影でわかりますが、CT、MRI、PETなどを行えば、ごく小さな骨病変でも見つけることができます。
こうした検査を行ない多発性骨髄腫の疑いがあれば、骨髄検査で確定診断を行います。骨盤の骨に針を刺し、骨髄液を抜き取って調べ、形質細胞の比率が10%以上に増えていると多発性骨髄腫と診断されます。また、確定診断のためには、血清中の免疫グロブリンを調べる血清免疫固定法検査や、血清FLC(フリーライトチェーン)検査も必要になります。
多発性骨髄腫のステージ分類と予後予測
多発性骨髄腫は、年齢、病型、病期、合併症などにより病状の経過が異なります。その他にも予後因子があり、治療に対する効果判定や予後予測が行われます。
多発性骨髄腫のステージ(病期)は、腫瘍の量と予後因子により、I~IIIの3段階に分けられます。アルブミン値(Alb)とβ2ミクログロブリン値(β2MG)に加え、染色体の異常も調べて判定します。Ⅰ期はAlb≧3.5g/dLかつβ2MG<3.5mg/dL、Ⅲ期はβ2MG≧5.5mg/dL、Ⅱ期はそれ以外、となっています(表1参照)。
染色体に関しては、「17番欠失」「4:14番転座」「14:16番転座」があると予後が悪いことがわかっています。
以前は、血液検査や骨髄検査で異常が見つかっていても、症状(CRAB)が現れていなければ治療する必要はないとされていました。症状がない段階を「くすぶり型骨髄腫」といいますが、この段階で治療を始めても、かつては生存期間を延ばすことができないため、骨折や腎不全が起きてから治療を始めていました。最近は新薬が登場したこともあり、もう少し早い段階で治療を開始することが推奨されています。
現在では、(1)骨髄の形質細胞比率が60%以上、(2)血清FLC比率が100以上、(3)MRIにて2か所以上の5mm以上の限局性骨病変、のいずれかがある場合には、治療を開始することが推奨されています。
表1 多発性骨髄腫のステージ分類
| I | 血清β2ミクログロブリン<3.5mg/L 血清アルブミン≧3.5g/dL |
| II | ⅠでもⅢでもないもの |
| III | 血清β2ミクログロブリン≧5.5mg/L |
造血器腫瘍診療ガイドライン2018年版を参考に作成
多発性骨髄腫の治療薬
多発性骨髄腫の薬物療法は、かつては抗がん剤のメルファラン(製品名:アルケラン)とステロイド剤のプレドニゾロンを併用するMP療法が中心でした。しかし、近年になって新規薬剤が次々と登場し、現在は9種類になっています。それにより、長期間にわたって病状をよい状態にコントロールできるようになってきました。
9種類の新規薬剤は、プロテアソーム阻害薬(ボルテゾミブ、カルフィルゾミブ、イキサゾミブ)、免疫調整薬(サリドマイド、レナリドミド、ポマリドミド)、ヒストン脱アセチル化酵素阻害薬(パノビノスタット)、抗体薬(エロツズマブ、ダラツムマブ)に分類されています(表2参照)。
9種類の新規薬剤のうち、未治療の多発性骨髄腫の治療に使用できるのは、ボルテゾミブとレナリドミドの2種類だけです。他の7種類は、再発・難治性多発性骨髄腫の治療薬として認可されています。再発した場合や、他の薬で治療して効果がなかった多発性骨髄腫の治療に使用することができます。
表2 多発性骨髄腫の治療薬一覧
| 薬のタイプ | 一般名(製品名) |
|---|---|
| プロテアソーム阻害薬 | ボルテゾミブ(ベルケイド)※ カルフィルゾミブ(カイプロリス) イキサゾミブ(ニンラーロ) |
| 免疫調整薬 | サリドマイド レナリドミド(レブラミド)※ ポマリドミド(ポマリスト) |
| ヒストン脱アセチル化酵素阻害薬 | パノビノスタット(ファリーダック) |
| 抗体薬 | エロツズマブ(エムプリシティ) ダラツムマブ(ダラザレックス) |
※未治療の多発性骨髄腫の治療に使用できる薬
多発性骨髄腫の治療アルゴリズム
未治療多発性骨髄腫の治療は、自家造血幹細胞移植の適応があるかないかによって、大きく2つに分けられます。「65歳未満・重篤な合併症なし・心肺機能正常」が適応の条件です。65歳は一応の目安で、全身状態が良好であれば、それ以上でも移植が行われることはあります。
自家造血幹細胞移植は、自分の末梢血から造血幹細胞を採取し、大量化学療法で骨髄中の細胞を死滅させた後、採取しておいた造血幹細胞を戻す治療です。移植した細胞は10日ほどで生着し、細胞の増殖が始まります。自分の細胞を戻す治療なので、他の人の幹細胞を移植する同種移植とは異なり、副作用が少なく、免疫抑制剤も必要ありません。
自家造血幹細胞移植による治療
導入療法として、新規薬剤を含む3剤併用療法が行われます。基本的に65歳未満なので、3剤併用にも十分に耐えられるからです。よく行われているのが、「ボルテゾミブ+レナリドミド+デキサメタゾン療法(BLd療法)」で、これを3~4コース行った後に末梢血中の幹細胞を採取します。
その後の大量化学療法ではメルファランが使われます。メルファランを通常の治療で使用する場合の用量は9mg/m2程度ですが、大量療法の用量は200mg/m2です。これによって、通常の投与量では死滅させられなかった腫瘍細胞を死滅させます。その後、採取しておいた自分の造血幹細胞を戻します。
図2 多発性骨髄腫治療アルゴリズム 自家造血幹細胞移植適応あり
| 移植適応のある初発多発性骨髄腫(65歳未満、重篤な合併症なし、心肺機能正常) | ||||
| ↓ | ↓ | ↓ | ||
| 推奨導入療法 新規薬剤を含む2剤導入療法 BD療法※1、Ld療法※2 (3~4コース) | 推奨導入療法 新規薬剤を含む3剤導入療法 BAD療法※3、BCD療法※4、 BLD療法※5、BTD療法※6 (3~4コース) | その他の導入療法 | ||
| ↓ | ↓ | ↓ | ||
| G-CSF単独※11、HD-CPA+G-CSF※12または、G-CSF+プレリキサフォル※13などで末梢血幹細胞採取 | ||||
| ↓ | ||||
| 自家造血幹細胞移植併用大量化学療法 | ||||
| ↓ | ||||
| 経過観察または臨床試験による地固め・維持療法 B、T、L+コルチコステロイドまたはタンデム移植 | ||||
造血器腫瘍診療ガイドライン2018年版を参考に作成
自家造血幹細胞移植を行えない場合の治療
自家造血幹細胞移植が適応にならない患者さんには、化学療法が行われます。高齢者が中心となることもあり、ボルテゾミブとレナリドミドの両方を含む併用療法は困難な場合も多いので、「レブラミド+デキサメタゾン療法(Ld療法)」あるいは「メルファラン+プレドニゾロン+ボルテゾミブ療法(MPB療法)」が推奨されています。
高齢者に対して、「ボルテゾミブ+レナリドミド+デキサメタゾン療法(BLd療法)」をそれぞれ減量した「BLdライト療法」が行われることもあります。臨床試験データがまだ十分ではありませんが、非常に成績がよく、副作用が少ないことが明らかになりつつあります。
図3 多発性骨髄腫治療アルゴリズム 自家造血幹細胞移植適応なし
| 移植非適応の初発多発性骨髄腫(65歳以上、重要臓器の障害あり、移植拒否) | ||
| ↓ | ↓ | |
| 推奨治療 MPB療法※14(9コース継続) Ld療法※2(18コース継続) | その他の治療 従来の治療:MP療法※15、CP療法※16、 VAD療法※7、HDD療法※8 改善の見込みが低くなるまで継続 新規薬剤レジメン:Bd療法※17、BLd療法※18、Td療法※19、MPT療法※20、 MPL療法※21、MPTB療法※22、CTd療法※23 | |
| ↓ | ↓ | |
| 奏効 | ||
| ↓ | ||
| 経過観察または臨床試験による維持療法 | ||
造血器腫瘍診療ガイドライン2018年版を参考に作成
| ※1 | BD療法 | ボルテゾミブ、デキサメサゾンの併用した導入療法 |
| ※2 | Ld療法 | レナリドミド、少量デキサメサゾンを併用した導入療法 |
| ※3 | BAD療法 | ボルテゾミブ、キソルビシン、デキサメタゾンを併用した導入療法 |
| ※4 | BCD療法 | ボルテゾミブ、シクロホスファミド、デキサメタゾンを併用した導入療法 |
| ※5 | BLD療法 | ボルテゾミブ、レナリドミド、デキサメタゾンを併用した導入療法 |
| ※6 | BTD療法 | ボルテゾミブ、サリドマイド、デキサメタゾンを併用した導入療法 |
| ※7 | VAD療法 | ビンクリスチン、ドキソルビジン、デキサメタゾンを併称した導入療法 |
| ※8 | HDD療法 | 大量のデキサメタゾンを使用した導入療法 |
| ※9 | TD療法 | サリドマイド、デキサメタゾンを併用した導入療法 |
| ※10 | TAD療法 | サリドマイド、ドキソルビジン、デキサメタゾンを併用した導入療法 |
| ※11 | G-CSF単独 | 末梢血中の好中球を増加させる薬による単独療法 |
| ※12 | HD-CPA+G-CSF | 大量シクロホスファミドとG-CSFを併用 |
| ※13 | G-CSF+プレリキサフォル | 骨髄から末梢血へ造血幹細胞を遊離する薬とG-CSFを併用 |
| ※14 | MPB療法 | メルファラン、プレドニゾロン、ボルテゾミブ併用療法 |
| ※15 | MP療法 | ルファラン、プレドニゾロン併用療法 |
| ※16 | CP療法 | シクロホスファミド、プレドニゾロン併用療法 |
| ※17 | Bd療法 | ボルテゾミブ、少量デキサメサゾン併用療法 |
| ※18 | BLd療法 | ボルテゾミブ、レナリドミド、少量デキサメサゾン併用療法法 |
| ※19 | Td療法 | サリドマイド、少量デキサメサゾン併用療法 |
| ※20 | MPT療法 | メルファラン、プレドニゾロン、サリドマイド併用療法 |
| ※21 | MPL療法 | メルファラン、プレドニゾロン、レナリドミド併用療法 |
| ※22 | MPTB療法 | メルファラン、プレドニゾロン、サリドマイド、ボルテゾミブ併用療法法 |
| ※23 | CTd療法 | シクロホスファミド、サリドマイド、少量デキサメサゾン併用療法 |
多発性骨髄腫の再発・難治性の治療
初回治療の最終投与日から9~12か月以上経過してからの再発や再燃した場合は、初回導入療法で使用したプロテアソーム阻害剤(ボルテゾミブ)や免疫調整薬(レナリドミド)を含む2~3剤を併用する救援療法を行うか、初回治療で使用していない薬に変更します。
初回治療終了後9~12か月未満に再発や再燃、進行や増悪した場合には、初回治療のキードラッグの効果が期待できないため、初回治療で使用していないキードラッグを含む救援療法が推奨されます。
どの薬をどのような順番で使用すればよいのかについては、明確にはなっていません。初回治療によって長期間の安定が得られた場合には、初回治療で用いた併用療法を繰り返してもよいことになっています。
再発・難治性の治療では、薬の投与時間や通院回数なども考慮します。たとえば、プロテアソーム阻害薬のカルフィルゾミブは、優れた効果を発揮する薬ですが、注射薬なので4週のうち3週は週2回通院する必要があります。これに対し、「レブラミド+デキサメタゾン療法(Ld療法)」なら、レブラミドは経口剤なので、月に1回の通院ですみます。ボルテゾミブは注射薬で週に1回の通院が必要です。これに対し、同じプロテアソーム阻害薬のイキサゾミブは経口剤で、月に3回内服すればよく、月に1回の通院ですみます。どのような治療を選択するかは、このようなことも考慮して総合的に判断するとよいでしょう。特に患者さんが高齢の場合や、病院が遠い場合などは、通院が大きな負担になることがあります。
図4 多発性骨髄腫の再発・進行の場合の治療
| 再発・再燃・難治性骨髄腫 | ||
| ↓ | ↓ | |
| 移植適応 | 移植非適応 | |
| ↓ | ↓ | |
| 救援療法(±臨床試験) 自家造血幹細胞移植 同種造血幹細胞移植 | 救援療法(±臨床試験) | |
| ↓ | ↓ | |
| 緩和医療 | ||
造血器腫瘍診療ガイドライン2018年版を参考に作成
多発性骨髄腫の治験
多発性骨髄腫の治療薬は、近年次々と新薬が登場していますが、進行中の治験がいくつもあり、この状況はまだ続きます。現在、次のような薬の治験が進行中です。
CAR-T療法
患者さん自身の末梢血からT細胞を採取し、がん細胞を攻撃するように遺伝子の組換えを行った後、培養して患者さんに戻す治療です。遺伝子治療と免疫治療を合わせたような治療といえます。アメリカでは非ホジキンリンパ腫とB細胞性急性リンパ芽球性白血病の治療薬として認可されています。
ベネトクラクス
染色体に「11:14番転座」がある多発性骨髄腫に対しては、単剤でもよく効くとされています。それ以外に対しても、併用では効果が期待できます。
セレネキソール
がん抑制たんぱくを核内にとどめる作用を持つ薬です。がん細胞はがん抑制たんぱくを核内から出してしまうので、それをとどめることで増殖を抑制します。
ベネトクラクスとセレネキソールは、これまでの新規薬剤とまったく異なる作用機序を持っている薬です。また、どちらも経口剤です。
これらのほか、現在使用されているダラツムマブの投与方法に関する治験も進行中です。従来は点滴で4時間かけて投与されていますが、皮下注射で投与した場合の有効性と安全性を調べる試験が行われています。皮下注射だと投与に要する時間は5分間になります。
プロフィール
石田禎夫(いしだただお)
2000年 札幌医科大学医学部助手
2001年 札幌医科大学医学部講師
2009年 札幌医科大学医学部准教授
2016年 日本赤十字社医療センター血液内科部長

