急性リンパ性白血病(ALL) 完治を目指す治療と再発・難治の新薬治療

2018.9 取材・文:星野美穂
血液がんの治療に関する最新情報は、「血液がんを知る」をご参照ください。
早ければ週単位で病状が進んでいく急性リンパ性白血病は、初診と同時に入院が必要となることも少なくない、治療の緊急度が高い疾患です。治療の第一目標は、強力な化学療法によって「完全寛解」を得ることです。その後は、地固め療法、維持療法と数年をかけて治癒を目指します。最近は、再発・難治例のための新規薬剤も次々に登場し、治療効果への期待が高まっています。
急性リンパ性白血病(ALL)/リンパ芽球性リンパ腫(LBL)とは
白血病は、血液細胞のがんです。血液中にある赤血球、血小板、白血球の血液細胞をつくる細胞が骨髄でがん化し、がん化した細胞が骨髄内で増殖して占拠するため、正常な血液細胞が減少し、感染症にかかりやすくなったり、貧血になったり、出血しやすくなったりなどさまざまな症状が起こります。
骨髄の中にある造血幹細胞は、赤血球、白血球、血小板などのすべての血液細胞のもとになる細胞として自己複製しながら、一方でさまざまな血液細胞へ分化していきます(図1参照)。造血幹細胞は、骨髄系の細胞とリンパ系の細胞に分化します。さらに骨髄系は、赤血球、血小板と、白血球のうちの顆粒球(好中球、好酸球、好塩基球)と単球へ分化します。リンパ系細胞は、白血球のうちT細胞(Tリンパ球)、B細胞(Bリンパ球)、NK細胞というリンパ球へと、成熟・分化して、血液の中に出ていきます。
白血病は、骨髄性やリンパ性、あるいは急性と慢性といった分類があります(表1参照)。血液の元となる細胞のうち、骨髄系細胞ががん化したものを骨髄性白血病、リンパ系細胞ががん化したものをリンパ性白血病といいます。さらに、それぞれ急性と慢性の白血病があります。急性の白血病では、骨髄の中で急速にがん細胞が増加して貧血や血小板減少、あるいは白血球の増加や減少をもたらし、発熱や貧血、出血傾向などの急性の症状が出現します。慢性の白血病では、そのような急性症状を呈しません。 急性リンパ性白血病(ALL:acute lymphoblastic leukemia、急性リンパ〔芽球〕性白血病)は、リンパ球が未成熟な段階のリンパ芽球の状態でがん化し急速に増え続ける病気で、急性の症状が現れます。
ALLと同じく、リンパ芽球ががん化する白血病に、リンパ芽球性リンパ腫(LBL:lymphoblastic leukemia)があります。両者は、同じ病気で同じ治療を行います。違いは、がん化したリンパ芽球細胞が主に増殖する場所が骨髄の内か外かという点です。
リンパ芽球は、骨髄の造血幹細胞から作られると、血液に乗って流れていき、全身のリンパ節で成長します。ALLでは、がん化したリンパ芽球が主に骨髄のなかで増殖します。LBLは、がん化したリンパ芽球が骨髄の外で増殖するものです。増殖する場所の多くは、脾臓や肝臓、頸部のリンパ節などです。
初期段階で、骨髄中の白血病細胞の割合が25%以上であればALL、25%未満であればLBLと診断上は区別されています。
ALLの年間発症数は、10万人に2~3人程度と考えられています。ALLは小児に多く、小児急性白血病の約8割がALLです。一方、成人ではすべての白血病のうち、約2割がALLとされています。
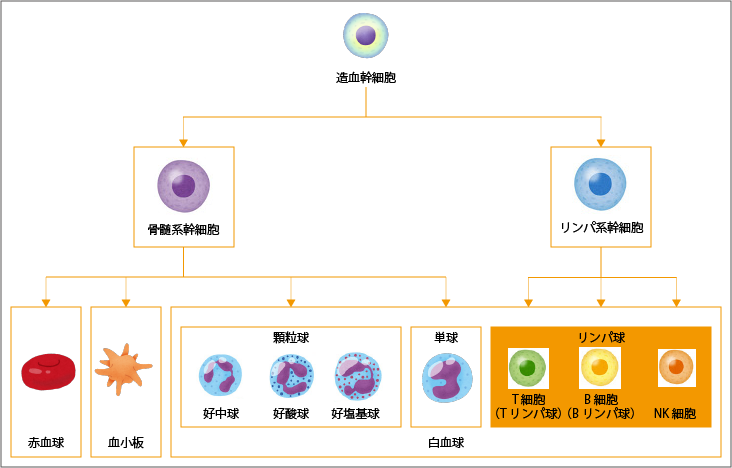
表1 白血病の主な分類
| 骨髄性 | リンパ性 | |
| 急性 | 急性骨髄性白血病 (AML: acute myeloid leukemia) | 急性リンパ性白血病 (ALL: acute lymphoblastic leukemia) |
| 慢性 | 慢性骨髄性白血病 (CML: chronic myelogenous leukemia) | 慢性リンパ性白血病 (CLL: chronic lymphocytic leukemia) |
急性リンパ性白血病の症状
急性リンパ性白血病の主な症状は、腫瘍化したリンパ芽球が骨髄のなかで増殖し、正常な血液を作る機能が妨げられることで現れるものと、腫瘍化した細胞が血流に乗り、さまざまな臓器やリンパ節に住みついて現れるものに分かれます(表2参照)。
正常な血液が作られないと次のような症状が現れます。白血球が不足すると、身体の抵抗性が低下し、ウイルスや細菌による感染を起こしやすくなります。赤血球が減少すると、だるい、眠い、疲れやすい、動悸、息切れといった貧血の症状が出ることがあります。また血液を凝固させる機能をもつ血小板が減少すると、出血しやすくなり、鼻血が出る、アザができやすくなるといった症状が現れます。
血流に乗ったリンパ芽球が臓器に侵入して増殖すると、リンパ節が腫れてしこりができたり、肝臓や脾臓が腫れてお腹が張ったりします。リンパ節や脾臓の腫れは成人のALLの約半数でみられます。中枢神経系に浸潤することも多く、物が二重に見えたり、頭痛や顔面の痺れなどが起こることもあります。
このようにさまざまな症状が現れますが、急性リンパ性白血病に特有の症状はなく、症状から特定するのは難しい病気です。
症状が全く出ない人もいます。こうした人は、健康診断などで血液の異常を指摘され、初期に病気が判明することが少なくありません。
表2 急性リンパ性白血病の主な症状
| 造血機能が妨げられて現れる症状 | 全身倦怠感(だるさ)、動悸・息切れ、めまい、易出血性(鼻血など)、紫斑(アザ)、皮下出血、感染症 |
| 発熱・盗汗〔多量の寝汗〕・体重減少 | |
| 白血病細胞が臓器やリンパ節に住みついて現れる症状 | リンパ節の腫れ |
| 肝臓や脾臓の腫れ(お腹が張る、痛い) | |
| 中枢神経系への浸潤(頭痛、吐き気・嘔吐、顔面のしびれ、視覚異常など) | |
| 骨への浸潤(腰痛、関節痛) | |
| 歯茎の腫れ、痛み |
急性リンパ性白血病の検査と診断
急性リンパ性白血病の診断には、血液検査と骨髄検査を行います。さまざまな手法で分析を行い、専門機関であれば急性白血病であることはすぐに診断でき、3日〜1週間ほどでどのようなタイプの急性白血病かという診断も確定します。
血液検査では、白血球、赤血球、血小板などの血球数の増減を調べます。また顕微鏡で細胞を観察し、白血病細胞(がん化したリンパ芽球)の有無を確認します。
骨髄検査では、腰の腸骨という骨に針を刺して骨髄液を採取し、染色体や遺伝子、細胞表面マーカーなどを調べます。
細胞表面抗原マーカー検査では、腫瘍細胞の表面に発現している抗原の有無とタイプを見分けます。がん化したリンパ球の種類が、T細胞なのかB細胞なのかなども調べます。
血液検査や骨髄検査と並行して、CTやレントゲンによる検査を行います。これは身体の中に病気がどのくらい広がっているかを確認するための検査です。
急性リンパ性白血病の染色体検査と遺伝子検査
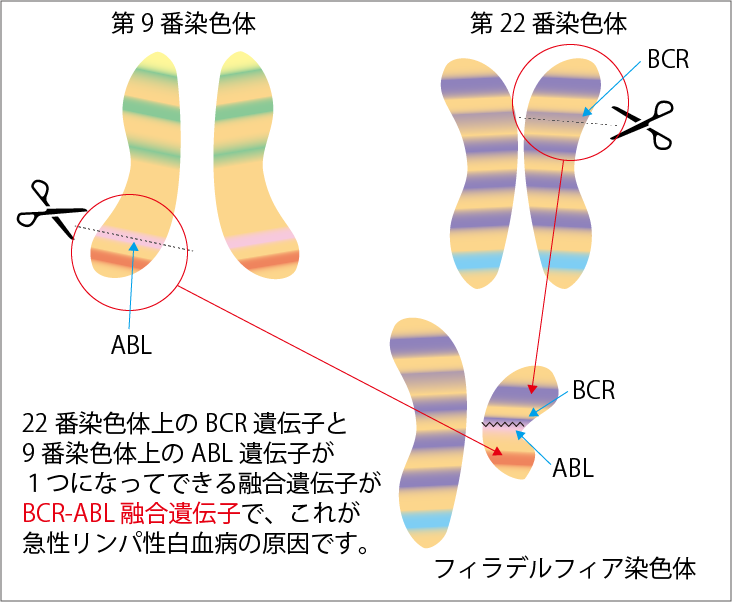
染色体検査では、フィラデルフィア染色体(Ph)の有無を確認します(図2参照)。フィラデルフィア染色体は、成人の急性リンパ性白血病で最も多い染色体の異常で、4人に1人に生じています。フィラデルフィア染色体がある場合をPh陽性、ない場合をPh陰性と呼びます。フィラデルフィア染色体は、BCR-ABL遺伝子の変異によって生じます。遺伝子検査では、このBCR-ABL遺伝子など特徴的に現れることのある遺伝子の変異の有無を検出します。
Ph陽性の急性リンパ性白血病では、フィラデルフィア染色体の遺伝子から作られる異常なタンパク質(BCR-ABLチロシンキナーゼ)が白血病細胞を増殖させることが知られています。
以前は、Ph陽性の予後は悪いと言われていました。しかし、BCR-ABLチロシンキナーゼを攻撃する新しい種類の抗がん剤(BCR-ABLチロシンキナーゼ阻害剤)が開発されて、治療成績が飛躍的に向上しました。現在、Ph陽性の治療には、このBCR-ABLチロシンキナーゼ阻害剤が使われます。Ph陽性かPh陰性かを知ることは、治療を組み立てるうえで非常に重要です。
急性リンパ性白血病の「完全寛解」を目指した治療
急性リンパ性白血病は進行が非常に早い病気です。治療をしないと週単位で容体が変化していきます。できるだけ速やかに治療を開始する必要があり、急性リンパ性白血病が予想されたら、確定診断を待つことなく、治療のベースとなるステロイドの投与が開始されることもあります。
治療の目的は、「完全寛解」の状態にすることです。「完全寛解」は、骨髄中の白血病細胞の割合が5%以下になった状態です。ただし、この病気は再発しやすいため、さらに治療を行い、白血球細胞を徹底的に叩いておく必要があります。そのため治療は、複数の抗がん剤を用いて白血病細胞を一気に減らすことを目標とする「寛解導入療法」、完全寛解が得られた後にさらに白血病細胞を減らすために行う「地固め療法」、さらに、完全寛解を維持するために行う「維持療法」の3つのステップで行います。
「寛解導入療法」は3〜4週間、「地固め療法」が1年程度、「維持療法」は1〜2年くらい行います。
Ph陰性の治療――抗がん剤の多剤併用療法
急性リンパ性白血病の治療は、Ph陰性かPh陽性かによって異なります(図3参照)。
Ph陰性の場合、ステロイドと、ビンクリスチン(製品名:オンコビン)、L-アスパラキナーゼ(製品名:ロイナーゼ)といった抗がん剤を組み合わせた多剤併用療法を行います。この治療は入院して行います。Ph陰性場合、約80%の患者さんがこの寛解導入療法で完全寛解に至ります。
地固め療法は、寛解導入療法で用いた複数の抗がん剤に、メトトレキサート(製品名:メソトレキセート)やシタラビン(製品名:キロサイド)などの別の種類の抗がん剤も加えて治療を行います。この治療も入院して行います。
寛解導入療法や地固め療法で得られた完全寛解を維持するために行うのが、維持療法です。主に外来で、経口の抗がん剤を中心にした治療を1〜2年ほど続けます。維持療法が終了した段階で寛解が維持されていれば、治療は終了します。その後定期的な観察続けて、長期間の完全寛解を得て、治癒を目指します。
維持療法までを経て完全寛解が得られたとしても、白血病は再発しやすい病気です。そのため、定期的な診察と検査は続けていく必要があります。
図3 急性リンパ性白血病の治療アルゴリズム(成人)
| Ph陽性急性リンパ性白血病 | ||||||||||
| ↓ | ↓ | |||||||||
| 若年者 | 高齢者 | |||||||||
| ↓ | ↓ | |||||||||
| TKI+多剤併用化学療法 | TKI+ステロイド療法 | |||||||||
| ↓ | ↓ | ↓ | ↓ | |||||||
| 寛解 | 非寛解 | 寛解 | 非寛解 | |||||||
| ↓ | ↓ | ↓ | ↓ | |||||||
| 地固め療法 | 救援療法 | 地固め療法 | 救援療法 | |||||||
| ↓ | ↓ | ↑ | ↓ | ↓ | ↑ | |||||
| 可能な場合同種移植 | 維持療法 | 再発 | 可能な場合同種移植 | 維持療法 | 再発 | |||||
| Ph陰性急性リンパ性白血病 | ||||
| ↓ | ↓ | |||
| 若年者 | 非若年者 | |||
| ↓ | ↓ | |||
| 小児プロトコル | 寛解導入療法 | |||
| ↓ | ↓ | |||
| 寛解 | 非寛解 | |||
| ↓ | ↓ | |||
| 地固め療法 | 救援療法 | |||
| ↓ | ↓ | ↓ | ||
| 維持療法 | 可能な場合同種移植 | 可能な場合同種移植 | ||
造血器腫瘍診療ガイドライン2018年版を参考に作成
Ph陽性の治療――チロシンキナーゼ阻害薬
Ph陽性の急性リンパ性白血病の場合、寛解導入療法において、上記の抗がん剤に加えてチロシンキナーゼ阻害薬(TKI)を併用します。これは、BCR-ABL遺伝子によってつくられるBcr-Ablタンパクをターゲットにし、Bcr-Ablタンパクが活性化するスイッチをオフにする分子標的薬です。TKIは複数の薬剤が発売されていますが、第一選択薬として使用されるのはイマチニブ(製品名:グリベック)です。Ph陽性の患者さんに対して、イマチニブを併用した多剤併用療法を行った場合、寛解率は90%以上です。
TKIは、ニロチニブ(製品名:タシグナ)、ダサチニブ(製品名:スプリセル)、ボスチニブ(製品名:ボシュリフ)の第二世代と言われる薬も登場し、治療選択肢が広がっています。
さらに第三世代薬として発売されたポナチニブ(製品名:アイクルシグ)は、上記の薬が効かなくなってきた(耐性が生じた)ときに使用される薬です。
Ph陽性の急性リンパ性白血病は、以前は抗がん剤にあまり効果が得られないことが多く、使える薬も少なかったのですが、今は治療の選択肢が増えてきています。最初の薬で効果が出なくても、次の手が用意されているので、治療をあきらめず続けていただきたいと思います。
再発・難治性の急性リンパ性白血病の治療
治療薬が効かず寛解に至らない、寛解したが再発したなど「再発・難治性」の患者さんに対しては、「救援療法」が行われます。最初の治療で効果が見られていれば同じ抗がん剤を、効果がなかった場合は別の抗がん剤を試していきます。これらは、研究段階の治療であり、これまで再発・難治性の急性リンパ性白血病の寛解率は30~50%と低いものでした。
2018年4月、再発・難治性の急性リンパ性白血病の治療薬として、イノツズマブオゾガマイシン(製品名:ベスポンサ)が発売になりました。がん細胞表面抗原マーカーであるCD22を目印としてがん細胞内に抗がん剤を運ぶことで効果を発揮するもので、CD22陽性の急性リンパ性白血病に使える薬です。CD22はB細胞性の急性リンパ性白血病のほぼすべてで発現しています。臨床試験において80%以上の高い寛解率を示し、期待が寄せられています。
さらに、米国や欧州連合(EU)では、再発または難治性のB前駆細胞性の急性リンパ性白血病の治療薬としてブリナツモマブ(製品名:ビーリンサイト)が承認されています。これは、がん細胞表面抗原マーカーのCD19と結合して正常なT細胞の免疫力を高めることにより抗がん作用を発揮する新しいタイプの薬で、日本でも2018年9月25日、再発または難治性のB細胞性急性リンパ性白血病の治療薬として、承認されました。
急性リンパ性白血病の同種造血幹細胞移植
抗がん剤による治療で体内の白血病細胞を減らしたあとに、提供者(ドナー)から採取された造血幹細胞を移植する治療です。移植された造血幹細胞が骨髄機能を回復し、正常な血液を作るのと同時に、体内に残っている白血病細胞を攻撃して白血病の再発を抑えます。
ただし、同種造血幹細胞移植は、白血球の型が一致する造血幹細胞のドナーが必要です。兄弟など血縁者に白血球の型が一致する人がいる場合、考慮される治療法です。患者さんの全身状態や年齢、移植によって起こる可能性のある合併症のリスクなどをよく考えて、検討する必要があります。
小児・AYA世代の急性リンパ性白血病の治療
小児と成人では、使用される薬剤はほぼ同じものが使われますが、使い方が異なります。小児では、薬の投与間隔を短くして休薬期間を設けない投与法(プロトコル)で強い治療を行います。副作用も激しく現れますが、小児のほうが副作用に耐える体の力が強いこともあり、高い治療効果が得られ、完全寛解率も8~9割と高いです。
最近、小児のプロトコルを若い成人世代に使うようになってきました。AYA世代と呼ばれる19〜30歳くらいの患者さんは、成人のプロトコルでは治療成績が芳しくありませんでした。ところが、小児プロトコルでは治療成績が上がることがわかり、若年者にも使用されるようになってきました。現在、小児プロトコルを使う年齢を少しずつ上げていく研究が行われています。
プロフィール
薄井紀子(うすい・のりこ)
1979年 東京慈恵会医科大学附属病院内科研修医
1981年 東京慈恵会医科大学第三内科入局
1988年 米国国立衛生研究所・国立癌研究所(NCI/NIH)に留学
2000年 東京慈恵会医科大学附属病院 血液・腫瘍内科診療部長
2008年 東京慈恵会医科大学附属第三病院 腫瘍・血液内科部長
2013年 東京慈恵会医科大学教授・同附属第三病院 輸血部診療部長
2018年 東京慈恵会医科大学客員教授・同附属第三病院 腫瘍・血液内科客員診療医長

