骨髄異形成症候群(MDS)、正確な検査と診断に基づく個別化治療

2018.9 取材・文:柄川明彦
血液がんの治療に関する最新情報は、「血液がんを知る」をご参照ください。
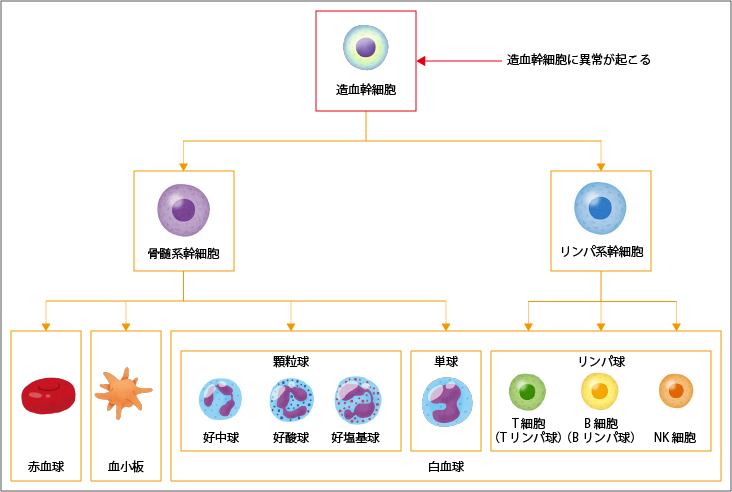
血液細胞は骨髄において造血幹細胞から産生されていますが、MDSではこの造血幹細胞が腫瘍化していると想定されています。腫瘍化したMDSの造血幹細胞は、細胞産生能に乏しく、末梢血では貧血や好中球減少、血小板減少が様々な程度に認められます。またMDSの造血幹細胞は形態に異常(異形成、dysplasia)があり、これがmyelodysplastic(骨髄異形成)の名前の由来です。
軽度の血球減少であれば経過観察のみで十分です。症状を呈する強い血球減少がある場合は、骨髄の状況(芽球比率や赤芽球の残存の程度)を勘案しながら治療を選択します。骨髄異形成症候群は、患者さんによりさまざまな病態があるため、正確な検査と熟練した専門の医師の診断と個別の病態に合わせた治療が大切です。
骨髄異形成症候群とは
骨髄異形成症候群 (myelodysplastic syndromes, MDS)の疾患概念と診断基準は1982年に確立され、今日までの約40年間に様々な知見が蓄積されてきました。
骨髄において造血幹細胞から産生される血液細胞は、リンパ系細胞(Tリンパ球、Bリンパ球、NK細胞)と骨髄系細胞(赤血球、好中球、血小板)に大別されますが、MDSはこの骨髄系細胞に由来する悪性腫瘍です。骨髄系細胞の悪性腫瘍には、他に急性骨髄性白血病、慢性骨髄性白血病などがあります。
腫瘍化したMDSの造血幹細胞は、細胞産生能に乏しく、末梢血では貧血や好中球減少、血小板減少が様々な程度に認められます。またMDSの造血幹細胞は形態に異常(異形成、dysplasia)があります。
このように骨髄異形成症候群(MDS)では血球が減少しますがMDS以外でも、様々な病気が血球減少を起こします。これらには、免疫の病気、腎臓病、肝臓病、慢性呼吸器疾患など書ききれない種類の病気があります。さらに、病院で処方される多くの薬(例えば高血圧の治療薬)で血球減少を起こす場合もあり、飲酒過多による血球減少も良く知られています。
MDSはこういった血球減少を起こす原因の中の一つで、その診断には他の原因ではないことを確認する必要があり、診断が難しいことで知られています。特に芽球の増加がない場合(例えば、骨髄で芽球が5%未満)や染色体検査で異常がない場合、MDSの診断には細心の注意が必要です。
また、約30%の症例では経過中に骨髄芽球が増加し、急性骨髄性白血病と区別のできない検査所見を示すようになります(これをMDSの白血病化と呼んでいますが、病状が急性骨髄性白血病と同じような経過をたどるわけではありません)。
骨髄異型性症候群は、明確な発症原因がない一次性MDS (de novo MDS, primary MDS) が多数を占めます。その他には、他の悪性腫瘍に対する抗がん剤治療や放射線治療の数年後に起きる治療関連性骨髄異型性症候群(therapy-related MDS) があります。近年、様々な悪性疾患に高用量化学療法を行う機会が増加し、そういった疾患の予後が改善してきたため、治療誘発性MDSの頻度が増加しつつあります。悪性リンパ腫の治療後や、他の血液疾患の治療後や自家・臍帯血・造血幹細胞などの移植後、固形がんの治療後にも見られます。現在、全MDS症例の10%内外が治療関連性MDSとされており、さらに、再生不良性貧血の経過中、特に抗胸腺細胞グロブリンによる治療を受けた例を10年前後観察すると、かなりの例でMDSが発症するという報告もあります。
MDSは高齢者に好発し、診断時の平均年齢は70歳前後です。MDSの発症率に関して、日本では十分な調査はなされていませんが、欧州での調査では、MDSの発症数は人口10万人あたり約3~12人/年で、70歳以上の年齢層では急激に増加し20~50人/年を超しています。米国の調査では、65歳以上の年齢層では人口10万人あたり75人/年の発症数です。高齢化が進む日本では、4人に1人が65歳以上であり、その数は3000万人を超えているので、この年齢層に上記の米国での発症頻度を適用すると、毎年22500人のMDS患者が新たに発症しており、 MDS患者の生存曲線から患者数をこの10倍と仮定すると、23万人程度となるはずです。高齢化社会では極めて重要な疾患であることがこれでわかるでしょう。
骨髄異形成症候群の症状と診断
患者は、貧血、だるさ、めまい、動悸、息切れなどの症状を感じて検査を受けたり、特に自覚症状はなく健康診断で血球数の異常を指摘されて精密検査を受けて診断された場合が多いです。
血液検査で何らかの血球の異常がみられた場合には、次に骨髄の検査が必要となりますので、この時点で専門家に依頼する場合が多いです。骨髄穿刺を行い、塗抹標本で細胞形態や芽球比率を算定し、穿刺液を用いて染色体分析を行うわけです。
MDSの主な症状は(1) 明確な血球の形態異常(異形成)、(2) 骨髄芽球比率の増加、(3) MDSに一致する核型異常です。(2)や(3)を認める場合、MDSの診断に十分経験がある者であれば、診断は比較的容易です。しかし(1)の血球形態異常は、巨赤芽球性貧血、ウイルス感染症、薬物、アルコールによる貧血、ベンゼンや亜鉛などへの暴露などでも認められるため、検査に加え、病歴や臨床経過を良く吟味しこれらの疾患を除外することが必要です。さらにこれらの除外を行っても、正常高齢者にも若干の造血細胞の異形成があるため、判断が難しくなります。またそもそも形態の評価は客観性に乏しいため、典型的なMDSでなければ、症例経験をつんだ者でも診断に苦慮することが多いようです。
私のもとには、大学病院や大病院の血液内科でMDSと診断された多くの方が受診されますが、その方々の診断を再検討すると、15%程度の方は誤ってMDSと診断されています。血液内科の中には移植医を標榜する医師もおり、誤った診断のまま幹細胞移植を勧めている事例も数多くみられます。こういったことは日本に限ったことではなく、国際MDS財団の創設者であるJohn M. Bennett医師によれば、米国での事情もほぼ同様である様です。
この事態は極めて深刻です。MDSの診断で最も重要なものは、骨髄細胞の顕微鏡検査です。正確な顕微鏡検査を行うためには、適切な骨髄検体を採取すること(少量を一気に取るこつをマスターしておく必要があります)、検体をガラス板に塗抹しこれに良い染色を施すこと(塗抹後すぐに乾燥させ、適切に調整した染色液を適切な時間反応させる必要があります)、染色した塗抹標本を観察し異形成の有無などを正しく読み取ることが必要です。今までセカンドオピニオンなどで他の施設の標本を数多くみせていただきましたが、骨髄検体が十分とれていないものや、染色の不良なものなどが数多くありました。また当然ながら塗抹標本の観察眼を磨くには、良い指導者から長期間の指導を受ける必要があり、指導者の質がとても重要になります。私は上記のJohn M. Bennett医師とともに、若手血液内科医や医学生に塗抹標本の観察を指導する会を催しましたが、今後も同様な機会を設けたいと思っています。
フローサイトメトリー (FCM)検査を御存知でしょうか。フローサイトメトリーは細胞の特性などに応じたレーザーの反応を、数値化・グラフ化する検査機器です。元々急性白血病やリンパ腫の診断に用いられてきた検査です。その機器を使用して、いくつかの研究チームがMDSの正しい診断のために研究を重ねていますが、急性白血病の診断の様に簡単にはいきません。現在のところ、私が開発したFCM解析法(Ogata-Protcol)が最も信頼性が高いとされており、既にNCCNガイドラインに採用され、WHO分類の改訂に採用する様にも国際研究グループから勧告されています。Ogata-Protcolでは、CD34という分子を持つ細胞を定量化し、骨髄液に含まれる細胞に対する比率を求めます。また、脱顆粒と呼ばれる顆粒がない好中球を識別して定量化します。これらの結果を、0点なら「骨髄異形成症候群の可能性はまずない」と考えられ、2点以上であれば「骨髄異形成症候群が非常に疑わしい」と考えられます。このスコアは「オガタ・スコア」と呼ばれ、診断の確認に有用であるとして、海外の複数のガイドラインで推奨されていますが、日本では、東京血液疾患診療所など少数の医療機関でしか行われていません。検査を御希望の方は、当方まで御連絡下さい。今後この検査が広まることで、正しく診断されることを願っています。
骨髄異形成症候群の病型分類とリスク分類
多くの骨髄異型性症候群の症例は血球減少を示します。貧血、血小板減少、白血球減少(主体は好中球減少)が、単独あるいは複数で認められますが、一方で、白血球増加を示したり、白血球分画の異常(骨髄芽球などの未熟細胞の出現や単球の増加)を示すこともありますし、また、原因不明のMCV (mean cellular volume)高値が診断のきっかけのこともあります。一部のMDS(refractory anemia with ringed sideroblastsと呼ばれる病型の方の一部)では血小板増多を示すこともあります。末梢血の好中球は、顆粒の減少や核の異形成を示すことがあります。細胞の異形成は、骨髄細胞で検討する方が分かりやすい場合が多いです。骨髄では細胞異形成に加え、骨髄芽球比率の増加をみることも多く、こういった細胞学的特徴を基に、病型分類がされています。表1にはWHO分類2008年の病型を示します。
「RCUD」「RARS」「RCMD」「5q-症候群」「MDS-U(分類不能型)」は、いずれも骨髄中の芽球の割合が5%未満の病型です。骨髄あるいは末梢血で芽球比率が5%を超えると「RAEB-1」「RAEB-2」という病型になり、芽球が20%以上になった場合には、「急性骨髄性白血病」と区別できないと言われる状態になります。
表1 骨髄異形成症候群の病型分類
| 病名 | 末梢血所見 | 骨髄所見 |
|---|---|---|
| 単一血球系統の異形成を伴う不応性血球減少症 (RCUD) 以下の病型含む ・不応性貧血(RA) ・不応性好中球減少症(RN) ・不応性血小板減少症(RT) | ・1-2系統の血球減少※1 ・芽球[-]またはごくわずか[1%未満]※2 | ・1血球系統で10%以上の細胞に異形成 ・芽球5%未満 ・赤芽球のうち環状鉄芽球15%未満 |
| 環状鉄芽球を伴う不応性貧血 (RARS) | ・貧血 ・芽球[-] | ・赤芽球系の異形成のみ ・赤芽球のうち環状鉄芽球15%以上 ・芽球5%未満 |
| 多血球系異形成を伴う不応性血球減少症 (RCMD) | ・血球減少 ・芽球[-]またはごくわずか[1%未満]※2 ・アウエル小体※3なし ・単球1×109/l未満 | ・2血球系統以上で10%以上の細胞に異形成 ・芽球5%未満 ・アウエル小体※3なし ・赤芽球のうち環状鉄芽球[±]15% |
| 芽球増加を伴う不応性貧血-1 (RAEB-1) | ・血球減少 ・芽球5%未満※2 ・アウエル小体※3なし ・単球1×109/l未満 | ・1~3血球系統に異形成 ・芽球5~9% ・アウエル小体※3なし |
| 芽球増加を伴う不応性貧血- (RAEB-2) | ・血球減少 ・芽球5~19% ・アウエル小体[±]※4 ・単球1×109/l未満 | ・1~3血球系統に異形成 ・芽球10~19% ・アウエル小体[±]※4 |
| 染色体異常(単独5番染色体長腕の欠失)を伴う骨髄異形成症候群:5q-(マイナス)症候群 (MDS associated with isolated del[5q]) | ・貧血 ・通常、血小板数は正常または増加 ・芽球[-]またはごくわずか[1%未満] | ・低分葉核を持つ巨核球が正常または増加 ・芽球5%未満 ・del[5q](5番染色体長腕の欠失)単独の染色体異常がみられる ・アウエル小体※3なし |
※1:時に2系統の血球減少が認められる。汎血球減少(3系統の血球減少)の際はMDS-Uに分類
※2:骨髄中の芽球が5%未満であり末梢血の芽球が2~4%の場合は、RAEB-1に分類
末梢血の芽球が1%のRCUDとRCMDは、MDS-Uに分類
※3:アウエル小体:正常な骨髄系白血球に存在する複数の顆粒が融合して桿(さお)状に変形したもので、骨髄性芽球を特徴づけ悪性度が高いことが多い
※4:末梢血中のアウエル小体が5%未満、骨髄中の芽球が10%未満でアウエル小体を認める場合は、RAEB-2に分類
WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues., 2008; 88-93, IARC.より作成
MDSの予後を左右するものは、多くの場合、正常細胞の減少です。通常、ヘモグロビン9 g/dL、好中球1000/mm 3、血小板2万/mm 3を超えている場合は、問題となる症状を起こすことは少ないのですが、ヘモグロビン6~7 g/dl程度になると輸血を要することが多くなります。好中球数は、500/mm 3以下では感染症のリスクが高まり、100/mm3以下が続くと感染はほぼ必発で、しばしば重症化します。血小板1万/mm 3以下では出血の症状が出ることが多く、強い症状であれば血小板輸血を要する場合もあります。芽球が増えた場合は血球減少がいっそう強くなるので、症状が強くなりますし、芽球の組織への浸潤により様々な症状を呈し、これが致命的になることも多いです。
血球減少の程度、骨髄の芽球比率、核型(染色体分析結果)などを総合して、予後予測を行います。核型を用いるのは、核型と芽球の増加との間に関連があるためです。最も多用されてきたリスク分類法を表2、表3に示します。
表2 IPSS-R予後因子スコア
| 予後因子の配点 | 0 | 0.5 | 1 | 1.5 | 2 | 3 | 4 |
|---|---|---|---|---|---|---|---|
| 核型 | Very Good | ― | Good | ― | Intermediate | Poor | Very poor |
| 骨髄芽球比率 | ≦2 | ― | >2~ <5 | ― | 5~10 | >10 | ― |
| Hb (g/dl) | ≧10 | ― | 8以上 10未満 | <8 | ― | ― | ― |
| 血小板 (×103/μL) | ≧100 | 50~ <100 | <50 | ― | ― | ― | ― |
| 好中球数 (×103/μL) | ≧0.8 | <0.8 | ― | ― | ― | ― | ― |
造血器腫瘍診療ガイドライン2018年版より
表3 IPSS-Rによる予後層別化
| リスク群 | 点数 |
| Very low | ≦1.5 |
| Low | >1.5~3 |
| Intermediate | >3~4.5 |
| High | >4.5~6 |
| Very high | >6 |
造血器腫瘍診療ガイドライン2018年版より
骨髄異形成症候群の治療
血球減少に対する治療
軽度の血球減少であれば経過観察のみで十分です。症状を呈する強い血球減少がある場合は、骨髄の状況(芽球比率や赤芽球の残存の程度)を勘案しながら治療を選択します。
貧血が強い場合は、運動能力が低下し、軽い動作で息切れなどが出やすく、また転倒のリスクも上昇します。血小板減少が強い患者が転倒すると、出血を起こしやすいので、特に頭部打撲には注意が必要です。MDSの貧血は骨髄での造血機能が低下することで起きています。赤血球産生の材料である鉄などは体内に十分あるにもかかわらず、骨髄での造血ができない状態であり、従って鉄などの補充は無効であるばかりか、有害であることの方が多いのです。鉄欠乏性貧血などで用いる、いわゆる貧血食は供しません。
骨髄芽球の少ない例では、アンドロジェンやシクロスポリンが奏効することがありますが、シクロスポリンは保険適用外です。
染色体検査で5q-(5番染色体長腕の部分欠損)を持ち、かつ他の染色体に異常がなく、IPSS予後スコア(表2)が低く、輸血依存性がある例では、レナリドマイド(製品名:レブラミド)が効果がある場合もありますが、日本人で5q-の染色体異常のみが単独で存在することは極めて稀です。
こういった治療を行いながら、貧血症状の強い例には適時輸血を行います。かつては、輸血を重ねると鉄分が蓄積しヘモクロマトーシスとなり、臓器障害を起こすことが問題でした。現在では、経口鉄キレート剤であるデフェラシロクスが使用可能であり、臓器障害の回避が可能となっています。長期に渡り輸血を繰り返す場合、フェリチン値などを参考にしながらデフェラシロクスの使用を考慮します。
また輸血が頻回になっている場合、エリスロポエチン製剤による治療を行う場合もあります。エリスロポエチンは造血作用を持つサイトカインです。かつては骨髄異形成症候群の治療の中心は輸血でしたが、エリスロポエチン製剤が使用できるようになって、輸血から解放されるケースもあります。血中のエリスロポエチン濃度が十分にあっても効果がある場合もあるので、試してみる価値はある治療です。
好中球減少で起きる感染は、細菌、真菌によるものです。特に好中球数200/mm3以下では起きやすくなります。感染予防のための口腔ケアは重要で、血小板が少なく出血しやすい場合は、柔らかいハブラシや綿棒など、出血を助長しない口腔ケアを指導します。肛門部も常に清潔にしておくことが重要です。シャワーなどに制限はなく、むしろ清潔を保つために行った方が良いです。また、動物との過度な接触(キスをしたり)、土いじりなど土やほこりを吸い込む危険がある行為は避けた方が無難です。
血小板減少による出血症状は、軽い場合は皮膚の点状出血ですが、皮膚の出血症状が広範になったり、粘膜出血が顕著になった(口腔粘膜の強い出血症状や下血など)場合は、多くの場合、血小板輸血などの対処が必要です。また、心筋梗塞の既往などで抗凝固剤を服用している患者さんは、血小板が一定のレベルを下回った場合は、抗凝固剤を中止した方が良いです。通常は血小板2万~5万以下を中止基準にしています。
骨髄異形成症候群に対する同種造血幹細胞移植
かつては同種造血幹細胞移植が、MDSの治癒をもたらす唯一の治療と考えられ、可能な限りこれを施行していた施設も多かったです。しかしながら、2004年の米国血液学会雑誌に、比較的若年者であってもMDS患者に早期に移植を行うと、移植関連死などによって、移植を行わない例に比べ予後が悪いことが報告されました。その報告で用いられたデータの多くは、造血幹細胞移植の発祥の地で、全米1の移植センターとも言われるFred Hutchinsonがんセンターのデータです。加えて最も成績が良いとされる比較的若い兄弟姉妹間の移植データであったため、関係者に与えた衝撃は大きいものでした。
その後も2012年に出されたMD Anderson がんセンターの論文でも脱メチル化剤(アザシチジンなど)と幹細胞移植の生存期間に対する効果は同等であり、「芽球の多いMDS (RAEB、RAEB-t)に対する造血幹細胞移植と輸血主体の治療の比較」と題された欧州多施設共同研究結果(2013年)によっても造血幹細胞移植と輸血主体の治療の生存予後はほとんど変わりませんでした。つまり、骨髄移植がその他の治療より生存予後を延長するという結果は得られなかったのです。
芽球が多い場合、血球減少が進行した場合の治療
芽球が多い場合には、アザシチジン(製品名:ビダーザ)による治療が中心となり、約40%程度で奏効します。通常の抗がん剤に比べ格段に副作用が少なく、アザシチジンの出現によってMDSの治療は劇的に変化しました。
効果がある場合は、芽球が減少し、血球が増加します。高リスクの患者さんを対象とした海外の臨床試験では、輸血などの支持療法や抗がん剤を使用した通常治療と、アザシチジン治療との、生存期間、生存率を比較した結果、通常治療の生存期間中央値が15.0か月だったのに比べ、アザシチジン治療では24.5か月に伸びたことが確認されました。また、2年後の生存率もアザシチジン治療群は50.8%であり、通常治療群よりも約2倍高いという結果でした。
アザシチジンによる治療は、ほとんど症状のない早期に開始してもメリットはあまりありません。病気が進行し、症状が現れてから開始することが勧められています。
投与は28日間を1サイクルとして、最初の1週間は1日1回、皮下注射または点滴静注で投与します。その後3週間は休薬。29日目から2サイクル目がはじまり、1週間投薬、3週間休薬を繰り返します。効果が現れるまでには、4~6サイクル(約半年程度)かかります。その後、効果がある間は投与を継続します。中には長年にわたり発症前とほとんど変わらぬQOLを保てる方もいます。
注意すべき副作用としては、骨髄抑制があります。白血球や血小板、赤血球などの血液細胞が減少し、身体を細菌やウイルスから守る防御機能が低下するため、感染症にかかりやすくなり、発熱などを起こします。出血もしやすくなります。あらかじめ医師や薬剤師から説明を聞き、疑わしい症状が出た場合は、速やかに医師の診察を受けることが大切です。
また、芽球増加のないMDSでも、治療不応の強い血球減少がある場合にアザシチジンが使用されることがあります。
またアザシチジンに続く治療薬がないため、副作用のために使用できない人やアザシチジンの効果がない人、効果があったけれども効果がなくなって来た人などは治療が大変難しくなっています。
そのような場合でも、アザシチジンを他の薬と組み合わせることで再度効果がでる場合もありますが、そのような治療は一般の治療機関では受けることは出来ません。
MDS治療の将来
現在、内外を問わず、新薬の開発は多くの製薬会社によって進められており、第3相試験まで進んでいる薬品もあります。また、白血病に使用されている薬品の適用拡大の試験を行っているものもあります。今後も治療は難しいとは思いますが、新しい薬品の登場により、MDS治療は様変わりしていくことでしょう。私たちもMDSに効果のある薬品を今後とも発掘していき、さらに治療を進化させ、完治を目指して努力していくつもりです。
骨髄異形成症候群は、病型やリスク分類が同じであっても、それぞれの患者さんによって、現れる症状や病気の進行などには大きな違いがあります。100人の骨髄異形成症候群の患者さんがいれば、100通りの治療が必要であるといえます。
プロフィール
緒方清行(おがたきよゆき)
1981年 日本医科大学付属病院第三内科入局
1992年 日本医科大学第三内科講師
1999年 日本医科大学第三内科助教授
2006年 日本医科大学血液内科学教授
2013年 (社)東京血液疾患研究所所長 新百合ヶ丘総合病院血液内科部長
2016年 東京血液疾患診療所院長

