がんのウイルス療法とは何か? 放射線やPD-1抗体薬と併用するがん免疫療法「テロメライシン」への期待

2019.2 取材・文:町口充
生体に感染したウイルスは細胞の中に入り込んで増殖し、細胞を次々と死滅させます。このウイルスの性質を逆手にとってがん治療に利用するのが、がんウイルス療法です。現在、さまざまなウイルスを用いてがん治療への応用が研究されていますが、岡山大学大学院医歯薬学総合研究科消化器外科学の藤原俊義教授らの研究グループは、がん細胞の中だけで増殖し、がんを破壊する腫瘍融解ウイルス製剤「テロメライシン」を開発しました。現在、食道がんに対して放射線と併用した治験(第I相試験)が進行中です。進行固形がんを対象に免疫チェックポイント阻害薬と併用する方法での治験も始まっており、結果が注目されています。
※2025年6月現在テロメライシンは、PMDAと先駆け総合評価相談中で、食道がんの適応で2025年12月に承認申請予定です(がん+編集部注)。
がんウイルス療法とは
細菌は1つの細胞からなる単細胞生物ですが、細胞として自分の力で増殖することができます。一方、細菌の50分の1ぐらいの大きさしかないウイルスは自分の細胞をもちません。このため、人や動物などの細胞の中に入り込んで増殖します。ウイルスは、体内に侵入し細胞内に入り込むと、細胞の増殖機構を借りて自分のコピーを次々につくります。ウイルスに感染された細胞は正常な機能を破壊され、新しいウイルスを放出して拡散すると死滅します。こうして起こるのがウイルス感染症です。
このように感染した細胞内で増殖・拡散することにより細胞を死滅させるウイルスの性質を利用してがんを死滅させる治療法が、がんウイルス療法です。
ウイルスによるがんの治療の可能性が注目されたきっかけとして、1971年に世界的な医学雑誌「Lancet」に掲載された論文が知られています。それは、アフリカでバーキットリンパ腫の子どもが麻疹を発症し、高熱などの症状が治まったときに、リンパ腫も完全寛解したというもので、ウイルス感染を経てがんが寛解に至ったという、医師による初めての報告でした。
このときのウイルスは普通に存在している野生型であるため、がん細胞だけでなく正常な細胞を殺す性質をもつため、がんの治療に用いることはできませんでした。それでも、ウイルスががん細胞を殺す特性をもつことに着目して、ウイルスを厳選してがん治療に応用するさまざまな研究が行われるようになり、現在では、アデノウイルスやヘルペスウイルス、レオウイルスといった腫瘍融解ウイルスを使ったがん治療薬の開発が世界中で行われています。
2015年には、米国のアムジェン社が開発した「T-VEC(製品名:IMLYGIC)」が米国と欧州でウイルス療法の治療薬として世界で初めて承認されました。ヘルペスウイルスに遺伝子改変を加えたもので、メラノーマ(悪性黒色種)の初回手術後に再発した切除不能な病変への局所治療が対象です。初めての治療薬が承認されたことでがんウイルス療法の研究・開発は勢いづき、臨床応用に向けた取り組みがいっそう活発になっています。
テロメライシンの開発1―アデノウイルスの活用
私たちが開発したテロメライシン(Telomelysin:未承認)は、風邪の原因となるアデノウイルスの遺伝子を改変したもので、がん細胞の中だけで増えてがん細胞だけを破壊するという治療薬です。
1991年から1993年まで米国テキサス大学MDアンダーソンがんセンターに留学し、無害化したアデノウイルスにp53というがん抑制遺伝子を組み込み、病巣に注入してがんを治療する新しい治療法の研究開発に携わりました。それが、アデノウイルスを用いた、このがん治療薬の開発のきっかけです。
ウイルスは太古の昔から感染症の原因として人類の脅威であった一方で、現在ではさまざまな病気の治療開発に盛んに活用されています。その代表となるのが、患者さんの体の中に特定の遺伝子を入れることによって病気を治す遺伝子治療です。その1つの手法として、患者さんから採取した細胞に、体外で改変した遺伝子を導入したあと、再び体の中に戻す治療法があり、そのときよく用いられるのがウイルスです。改変した遺伝子を細胞に導入するためには、細胞の核の中のDNAまで遺伝子を運んでくれる「ベクター(遺伝子の運び屋)」が必要であり、ウイルスがそのベクターの働きをするのです。
通常、アデノウイルスに感染すると、軽い風邪程度の症状から重症の扁桃腺炎や肺炎、結膜炎などさまざまな炎症を引き起こします。
留学していた当時はまだ、ウイルスを人の体内に注入して安全かどうか確かめられていなかったため、アデノウイルスが増殖しようとする機能は取り除いて、「増えないアデノウイルス」として無害化したうえでウイルスベクターとして使っていました。つまり、ウイルスを体内に入れることによって感染はするけれども増殖することはなく、治療遺伝子として働いて病気を治します。これがp53遺伝子発現アデノウイルスベクターによる遺伝子治療であり、1999年、日本で初めて肺がんの患者さんを対象にこの治療を行い、腫瘍の増大を抑えるなどの効果を確認しています。
このように、1999年当時は「増えないアデノウイルス」を用いたがん治療を開発していましたが、2002年から、より高いがん治療効果を求めて、新たに「増えるアデノウイルス」を用いた開発を進め、テロメライシンとして完成させました。
テロメライシンの開発2―テロメラーゼ活性を利用
私たち人間など動物の体の大半の細胞には寿命があります。その寿命を決めているのは、染色体の末端にあって染色体を守る役割をするテロメアという部分です。
私たちは細胞分裂を繰り返すことによって生命を維持しています。細胞が分裂するときには染色体がコピーされますが、テロメアはコピーされず、細胞が分裂するたびに徐々に短くなっていきます。短くなってやがてテロメアがなくなってしまえば細胞分裂は停止し、細胞は死滅します。テロメアは使いきると細胞が死ぬため、「命の回数券」とも呼ばれています。そのテロメアを維持する酵素にテロメアーゼがあり、その働きによってテロメアは短くならず細胞は死ななくなります。
テロメラーゼの発見は比較的最近のことであり、テロメアとテロメラーゼの仕組みを解明した米国のブラックバーン博士は2009年のノーベル生理学・医学賞を受賞しています。
人のテロメラーゼは細胞が生まれた当初は高い活性をもつものの、成長すると働きが抑えられます。これに対して、テロメラーゼが活性化し続けている細胞があり、それががん細胞です。がん細胞の約90%は高いテロメラーゼ活性をもつといわれています。このため、がん細胞は老化することなく、不死の細胞として増殖を続けていくのです。テロメラーゼ活性があるかないかは、正常細胞とがん細胞との大きな違いとなります。
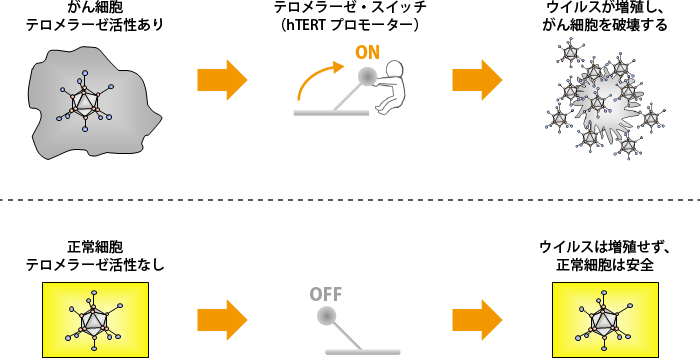
私たちは「増えるアデノウイルス」によるがん治療を開発するにあたり、がん細胞では増殖するが、正常細胞では増殖しないようにアデノウイルスを改変する方法を考え、ひらめいたのが「テロメラーゼ活性あり・なし」を利用することでした。テロメラーゼ活性のある細胞だけで働くようにしたアデノウイルスを投与すれば、がん細胞だけでウイルスは働いてがんを殺し、テロメラーゼ活性のない正常細胞には何の影響も与えないはずです。
テロメラーゼが働くには、そのスイッチの役割をするプロモーター(hTERTプロモーター)が関与することがわかっています。そこで、アデノウイルスの染色体のE1領域と呼ばれるウイルスの増殖に必要な部分に、テロメラーゼ活性がある場所に行くとスイッチがオンとなるhTERTプロモーターを組み込みました。これが、テロメライシンです(図1、2)。テロメラーゼ活性が高いがん細胞に入るとスイッチはオンとなり、本来ウイルスがもつ細胞を殺す機能が働きます。一方で正常な細胞ではスイッチがオフになるため、ウイルスとしての悪さ(増殖)はしません(図3)。
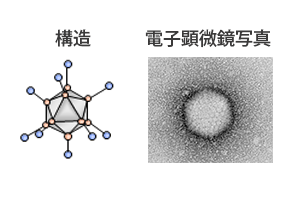
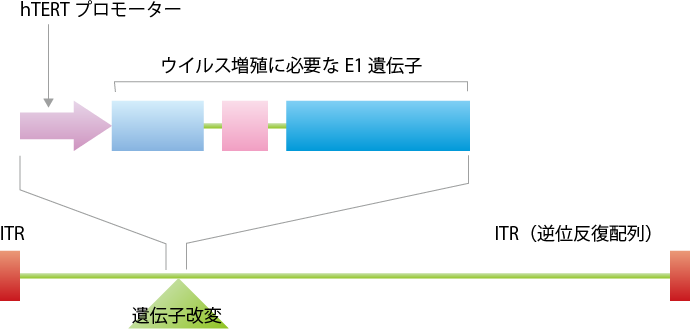
テロメライシンの開発3―食道がんの臨床研究
岡山大学病院で2013年から食道がんの患者さんを対象に、内視鏡を用いてテロメライシンを腫瘍内に投与し放射線療法を併用する治療の臨床研究を行いました。臨床研究に先立って行われた動物実験では、テロメライシンの投与に放射線を併用すると、腫瘍が縮小したり消失する作用があることが確認されました(図4)。
局所進行の食道がんに対する標準治療では、抗がん剤を投与した後に手術が行われます。しかし、嚥下機能や呼吸機能への影響が大きいことや、合併症をもつ高齢の患者さんが多いことから、広い範囲のリンパ節切除を伴う手術や、強い副作用を伴う化学療法が難しい症例が増えています。標準治療が難しい患者さんに対する新たな「体にやさしい治療」が望まれており、テロメライシンを用いたウイルス療法はそれにふさわしい治療法と考えられました。
治療は、1日目に内視鏡を用いて食道患部の5か所にテロメライシンを投与し、4日目から週10Gyの放射線治療を6週間、計60Gy照射し、その間に18日目と32日目にテロメライシンの腫瘍内投与を追加するというスケジュールで行いました。
研究は、合計13人の53~92歳の食道がんの患者さんを対象に、安全性を考慮してテロメライシンの投与量をレベル1~3の3段階に設定して行いました。投与量が最も少ないレベル1から実施し、最初の7例には、高容量(1×1012virus particles [vp])の100分の1の量である低容量(1×1010vp)を5か所に分けて投与しました。次の3例には10分の1の中容量(1×1011vp)を、残りの3例には高容量を投与して経過を観察しました。
有害事象としては、発熱、白血球減少などが60%以上でみられ、症状のない一過性のリンパ球減少は全例に認められましたが、レベル1~3ともいずれも回復しており、重篤な副作用はありませんでした。
臨床効果については、評価可能な12例中11例で腫瘍縮小が認められ、うち8例では食道の腫瘍が完全に消失(完全奏効)し、部分奏効は3例でした。X線検査や理学的検査で腫瘍の縮小が評価される客観的奏効率(ORR)は91.7%に達し、触診や画像検査などで腫瘍の消失が確認される臨床的完全寛解(cCR)はステージIの患者さんでは83.3%、ステージII、IIIの患者さんでは60.0%でみられました。
日本食道学会のデータでは、放射線治療のみを受けた症例ではcCR率がステージIで56.7%、ステージII、IIIで26.8%であり、テロメライシンの上乗せ効果があると考えられます。
以上の結果から安全性と有効性が確認でき、研究成果は2018年7月の日本臨床腫瘍学会で、2019年1月には米国臨床腫瘍学会消化器がんシンポジウム(ASCO-GI)で発表され、注目を集めました。
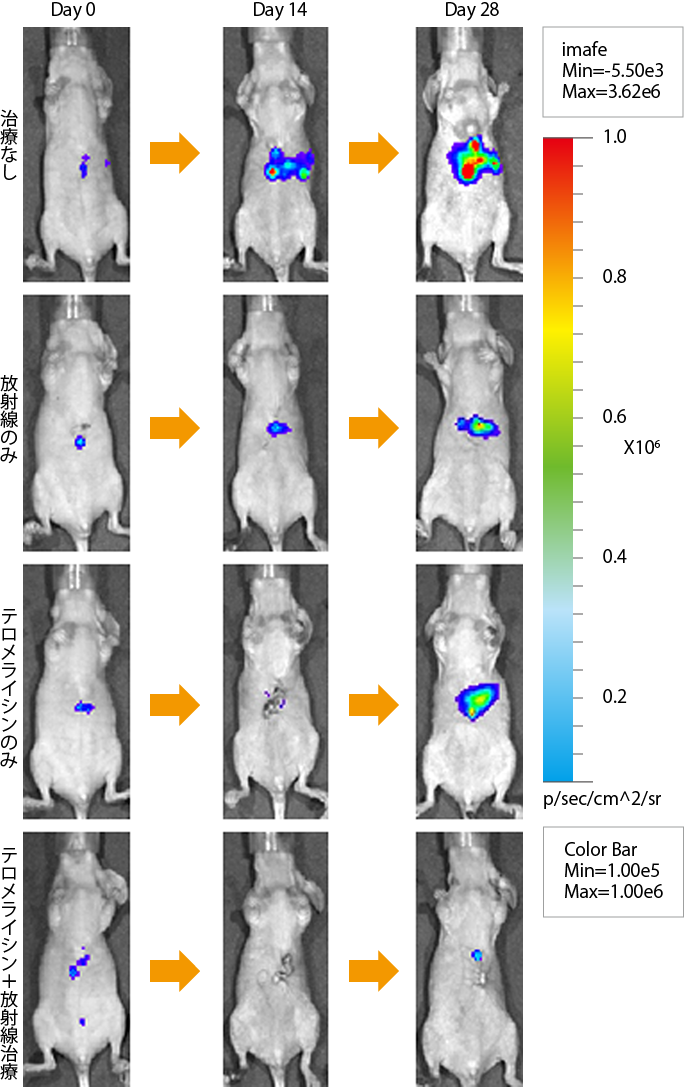
テロメライシンの開発4―免疫チェックポイント阻害薬との併用
臨床研究の結果を受けて、実用化に向けた動きも急ピッチとなっています。
テロメライシンなどウイルス療法に用いる新規がん治療薬の開発を目的に、2004年には岡山大学発のバイオベンチャー「オンコリスバイオファーマ」を設立しています。岡山大学病院での臨床研究を受けて、2017年7月からは放射線治療との併用による同じ内容で岡山大学と国立がん研究センター東病院の2施設で、第I相の企業主導の治験を開始しています(表)。順調に進めば第I相臨床試験を終えて2019年からは第II相臨床試験に移行する予定です。
実は、テロメライシンの第I相の臨床試験は日本に先駆けて米国で行われています。進行固形がんの患者さん22人を対象にテロメライシンを1回だけ投与、あるいは最後の6人では1週間おきに5回投与により、安全性の確認が行われており、この結果を踏まえての日本での治験となっています。
現在のところ、国内では食道がん治療での実用化をめざしていますが、直腸がんなどほかのがん種にも有効と考えられており、将来的にはがん種の拡大も視野に入れています。
放射線以外の治療法との併用の試みも始まっています。国立がん研究センター東病院と岡山大学病院の2施設では、2018年3月からテロメライシンと免疫チェックポイント阻害薬とを併用した治療の医師主導治験を開始しました。この治験では進行性・転移性の食道がんだけでなくほかの固形がんも対象としていて、28人の患者さんにテロメライシンを投与したあと抗PD-1抗体であるペムブロリズマブ(製品名:キイトルーダ)を投与します。テロメライシンががん細胞を殺すとともに免疫細胞の攻撃能力が高まり、より強い治療効果が得られると期待されています。
テロメライシンとペムブロリズマブを併用した医師主導治験は米国でも計画・準備中で、進行性・転移性の食道がんが対象です。
また米国では2017年7月からメラノーマを対象としたテロメライシン単剤での第II相治験が進行中です。
台湾、韓国、中国などでは、アジア圏で患者数の多い肝細胞がんを対象としたテロメライシンによる治療法の開発が進められています。台湾と韓国で、肝細胞がんを対象にした第I相の治験が進行中であり、中国でも肝臓がんを対象にした治験が計画段階にあります。
表 テロメライシンの臨床試験(国内・登録中※)
| 治験名 | フェーズ | 選択基準(抜粋) |
|---|---|---|
| 悪性腫瘍(食道がん)に対する放射線併用テロメライシン療法 | 第I相臨床試験 | 外科切除による根治が不能な局所進行例 |
| 術後再発し、追加切除が困難な症例 | ||
| ウイルス液の局所注入が可能な症例であること | ||
| 腫瘍の面積が1cm2より大きく、25cm2より小さいこと | ||
| 12週以上の生存が期待でき、PSが2以下、など | ||
| 進行性・転移性固形がんに対するペムブロリズマブ併用テロメライシン療法 | 第I相臨床試験 | 外科的切除、または標準的な化学療法が不能な症例 |
| 治療対象病変に局所注入が可能な症例 | ||
| 20歳以上90歳未満 | ||
| 各種臓器機能が保たれていること、など |
※2019年2月時点
がんウイルス療法と免疫効果
テロメライシンの代表的な特長として、以下のような点が挙げられます。
1つは、がん細胞のみで増殖して効果を発揮する点です。このためほかの正常細胞に影響を与えることはありません。また、アデノウイルスは風邪の症状をもたらすウイルスで発熱などの症状を引き起こすものの、空気中にも存在するものであり、他のウイルス製剤と比較しても安全性が高いとされています。そのうえ、アデノウイルスによる感染はほとんどの人が子どものころに経験しているので、体の中に抗体ができています。このため、腫瘍に投与したテロメライシンが腫瘍の外に出ても、すぐに抗体が作用しアデノウイルスが細胞に取り付くのを阻止して感染を防ぐので、より安全度が高いといえます。
もう1つは、放射線治療との併用による相乗効果です。放射線はがん細胞のDNAを分断し殺すことで治療効果を発揮しますが、一方で、がん細胞には放射線を浴びて壊れたDNAを修復する機能があります。この機能が働くと放射線治療は効きにくくなってしまいます。ところが、テロメライシンの遺伝子がつくるタンパク質は、がん細胞のDNA修復に働くタンパク質を分解する働きをもつことがわかりました。
つまり、放射線治療でがん細胞のDNAが破壊されたところにテロメライシンが投与されると、がん細胞がDNAを修復する機能をもテロメライシンがブロックするため、放射線治療の効果は高まることになるのです。
さらに、テロメライシンの投与は体がもともともっている免疫を活性化させることもわかっています。例えば、アデノウイルスの感染によりがん細胞が破壊されると、免疫細胞が異物を認識して排除する免疫応答が呼び覚まされ、強まった免疫の力ががん細胞を攻撃するようになります。つまり、ウイルスががん細胞を殺すだけでなく、それによって誘導された免疫反応によってもがん細胞を死滅させるのです。この現象は、免疫原性細胞死(Immunogenic Cell Death:ICD)と呼ばれるものです。
放射線治療でも同様の現象が起こることがわかっており、「アブスコパル効果」と呼ばれています。がん細胞に放射線を照射する治療を行うと、照射によって破壊されたがん細胞から免疫刺激作用のあるタンパク質やがん抗原などが放出されます。すると、それに対する免疫応答が起こって細胞傷害性T細胞が活性化し、放射線が当たらなかった遠くの場所にあるがん細胞まで探し出して攻撃するというものです。テロメライシンによる治療は、内視鏡を用いて腫瘍に投与する局所治療として行われますが、同時に全身の免疫を活性化している可能性があります。
実際、マウスの実験ではテロメライシンの投与により全身の免疫が活性化しているのが確かめられており、PD-1抗体と併用したマウスの実験でも非常に高い効果が認められています。
ほかにも、放射線を当てるとアデノウイルスと結合しやすくなるレセプター(受容体)ががん細胞表面に増えることが発見されています。レセプターが増えればアデノウイルスはがん細胞に感染しやすくなり、抗腫瘍効果はより高くなります。
臨床研究では、このようなテロメライシンの特性を十分に計算に入れ、投与方法にも工夫が凝らされています。
たとえば、臨床研究では1日目に内視鏡を用いて食道の患部にテロメライシンを投与し、間を置いて4日目から放射線治療を始めます。これは、放射線治療で生じるDNA損傷をがん細胞が修復しようとするのを、3日間をかけて十分に増やしたウイルスによって阻止するのがねらいです。
臨床研究では18日目と32日目にテロメライシンの腫瘍内投与を追加しますが、18日目と32日目はどちらも午前中に放射線を照射し、午後にウイルスを投与します。これは、放射線が当たると、がん細胞の表面にアデノウイルスに感染しやすくなるレセプターがたくさん出るようになるのをねらったものです。
いずれも、テロメライシンと放射線治療のそれぞれの特徴を生かした相乗効果を上げるための投与法です。
テロメライシンを活用した診断法
次世代型のテロメライシンの開発も進んでいます。その1つは、がん化した細胞を自然死させる抑制遺伝子p53をテロメライシンに組み込んで、より有効性を高めたウイルス療法薬です。p53には免疫原性細胞死を誘導する働きがあるとの報告もあり、期待されています。
また、テロメライシンを診断に活用することも研究されていて、テロメライシンに緑色蛍光タンパク質(GFP)を組み込んだ遺伝子改変ウイルス「テロメスキャン」が開発されています。GFPはオワンクラゲから発見された蛍光タンパク質で、1962年に下村脩博士により発見され、2008年にノーベル化学賞が授与されたのは記憶に新しいところです。
がん細胞にテロメスキャンを感染させると緑色に光るので、局所のがんはもちろん、転移の原因となると考えられる血中に循環しているがん細胞を検出することも可能となります。従来の腫瘍マーカーより敏感に治療効果をモニターすることができるのではないかと注目されています。
がんウイルス療法の実用化に向けた取り組み
なお、ウイルス療法の実用化に向けた治験や研究はテロメライシン以外でも活発に取り組まれています。
東京大学では脳腫瘍の一種である膠芽種(こうがしゅ)の患者さんを対象に、ヘルペスウイルスを用いた薬の医師主導の第II相臨床試験が進行中(被験者登録は終了)。治療薬として使われるのは、G47Δ(デルタ)という第3世代遺伝子組換え単純ヘルペスI型ウイルスです。※
※2021年6月11日、がん治療用ウイルス「テセルパツレブ」(製品名:デリタクト、開発コード:DS-1647、G47Δ)が、悪性神経膠腫を対象とした再生医療等製品として、条件及び期限付きの製造販売承認を取得しました(編集部注)
鹿児島大学でも、がん細胞のみを死滅させるようにアデノウイルスを遺伝子改変した「サバイビン反応性m-CRA」というウイルス医薬を開発しています。骨転移、軟部腫瘍転移、悪性骨腫瘍、悪性軟部腫瘍を有する患者さんを対象に医師主導の第I相臨床試験が2016年から開始されています。
東京大学の別の研究グループでは、麻疹ウイルスを使った新たな治療法を開発しています。マウスを使った実験では乳がんや肺がんに効果があったということで、臨床研究の準備が進んでいるということです。
また、鳥取大学では、かつて天然痘のワクチンとして使われていたワクシニアウイルスの遺伝子を改変したウイルス製剤をアステラス製薬と共同開発し、実用化をめざす取り組みを始めています。
ほかにも、各研究機関や第一三共、タカラバイオなどの製薬会社も開発に乗り出していますが、実際に臨床で使われるようになるにはまだ時間がかかりそうです。ただし、現在は、かつていわれたような「ドラッグ・ラグ」、つまり、海外で使われている薬が日本では承認までに長い時間を要してなかなか使えないという問題が解消されてきています。
さらに、再生医療や遺伝子治療に使われる薬は、最速での承認が可能になっているため、臨床試験の結果次第では、早期の実用化に期待がもてます。これは、2014年11月に施行された法律により、再生医療や遺伝子治療に使われる薬については安全性が確認され有効性が推定されれば、有効性を確かめる大規模治験を経ないでも早期承認が得られるようになっています。山中伸弥教授のiPS細胞の発見をきっかけに、日本を、遺伝子治療を含む再生医療等製品の開発先進国にしようという意図のもとに始まった制度で、たとえば第I相、第II相治験で安全性の確認と有効性の推定が得られたところで「条件付き承認」として、一定期間を保険診療で患者さんの治療データを集積・解析し、最終的に本承認を得ることになります。
承認に至るまでの開発コストの大幅削減や承認審査期間の大幅短縮が期待できるので、再生医療や遺伝子治療の開発に取り組む研究機関や製薬会社にとっては追い風となっています。こうした新しい制度にも後押しされて、ウイルス療法の開発は日々進歩しています。ウイルスを使った革新的ながん治療薬が、がん治療の現場に登場する日も近いことでしょう。
プロフィール
藤原俊義(ふじわら・としよし)
1991年 米国テキサス大学MDアンダーソンがんセンター腫瘍生物学教室
1992年 米国テキサス大学MDアンダーソンがんセンター胸部心臓血管外科
1994年 岡山大学医学部附属病院医員
2003年 岡山大学医学部附属病院助教授(遺伝子・細胞治療センター)
2010年 岡山大学大学院医歯薬学総合研究科消化器・腫瘍外科学教授
2011年 岡山大学大学院医歯薬学総合研究科消化器外科学教授(名称変更)

