神経内分泌腫瘍の診断と治療―がんゲノム医療と内用療法(PRRT)がもたらす進歩―

2022.9 取材・文:がん+編集部
神経内分泌腫瘍の治療に関する最新情報は、「神経内分泌腫瘍を知る」をご参照ください。
神経内分泌腫瘍は、全身の内分泌細胞から発生する希少がんです。診断や治療は、複数の診療科が連携して行っていきます。神経内分泌腫瘍の診断では、病理分類が重要で、病理診断に基づいて薬物療法の選択が行われます。WHO分類の改訂、新たな検査、手術、薬物療法などの登場により、神経内分泌腫瘍の診断や治療は進歩しています。国立がん研究センター中央病院肝胆膵内科医長で、神経内分泌腫瘍の診療に長年携わって来られている肱岡 範先生に、神経内分泌腫瘍の診断と標準治療、注目されている治療について解説していただきました。
神経内分泌腫瘍とは
神経内分泌腫瘍「NEN(ネン):Neuroendocrine Neoplasm」は、全身にある神経内分泌細胞から発生する腫瘍です。神経内分泌細胞は、ホルモンやペプチド(アミノ酸が2個以上つながったもの)を分泌する細胞で、膵臓、消化管、肺などさまざまな臓器にあります。NENは消化器にできるものが約60%、肺や気管支にできるものが約30%とされています。消化器の中では、特に膵臓や直腸に多く発生します。罹患率は、年間10万人のうち、3~5人程度です。
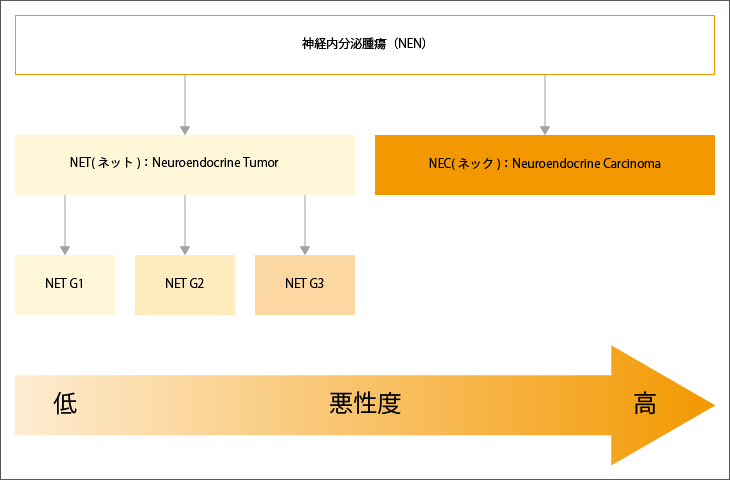
NENは細胞の分化の程度で、高分化型の「NET(ネット):Neuroendocrine Tumor」と低分化型の「NEC(ネック):Neuroendocrine Carcinoma」に分類されます。高分化型は正常な細胞の形に近く、低分化型は正常な細胞とは異なり未熟な形をしています。
さらに、NETは、ホルモンによる症状の有無で、「機能性NET」と「非機能性NET」に分類されます。機能性NETのうち、インスリンを分泌する膵β細胞から発生したNETを「インスリノーマ」といい、ガストリン産生細胞から発生したNETを「ガストリノーマ」といいます。
| NET(ネット): Neuroendocrine Tumor | NEC(ネック): Neuroendocrine Carcinoma | |
| 機能性NET | 非機能性NET | |
症状
非機能性NETの場合は、ホルモンの作用による特徴的な症状はなく、腹痛や腹部膨満感などの症状が起こることがあります。
機能性NETは、「インスリン」「ガストリン」「ソマトスタチン」などのホルモンを過剰に産出することがあり、これが原因でさまざまな症状が起こります。インスリンが過剰に分泌されると低血糖状態となり、冷や汗、動悸、意識障害などの症状が起こります。ガストリンが過剰に分泌されると胃液が過剰となり、胃・十二指腸潰瘍、慢性下痢、腹痛、胸焼け、体重減少などの症状が起こります。ソマトスタチンは、他のホルモンの働きを抑制する働きがあります。例えば、インスリンの分泌が抑制されることで、血糖値が高くなることがあり、体重減少や腹痛のほか、糖尿病、胆石症、脂肪便、下痢、貧血などの症状が起こります。
神経内分泌腫瘍の分類
膵・消化管NETは、「部位」「進行度」「悪性度」「ホルモン症状の有無」「遺伝子疾患の有無」など、さまざまな観点から分類され、この分類は治療方針を決めるうえで考慮されます。
部位による分類
NETは発生部位と発生学的な特徴により、「前腸」「中腸」「後腸」の3つに分類されます。前腸は、肺・気管支、胃・十二指腸、膵臓です。中腸は、小腸、虫垂、結腸(右半分)です。後腸は、結腸(左半分)と直腸です。
ステージ分類(TNM分類)
がんのステージ分類は、原発腫瘍の大きさや浸潤の程度(T分類)、リンパ節への転移(N分類)、遠隔部位への転移(M分類)で決定されます。
- T:原発腫瘍の大きさや浸潤の程度
- N:リンパ節への転移
- M:遠隔部位への転移
ステージは1~4に分類されます。
膵NETのTNM分類
NETのステージ分類は、「膵NET」と「消化管NET」でステージ分類が異なります。膵NETのステージ分類は、TNM分類で行われます。
T分類
| TX | 原発腫瘍の評価が不可能 |
| T0 | 原発腫瘍を認めない |
| T1 | 膵内に限局し、最大径が2cm以下の腫瘍 |
| T2 | 膵内に限局し、最大径が2cmを越えるが4cm以下の腫瘍 |
| T3 | 膵内に限局し、最大径が4cmを越える腫瘍または十二指腸もしくは胆管に浸潤する腫瘍 |
| T4 | 隣接する臓器(胃、脾、結腸、副腎)または大血管(腹腔動脈幹または上腸間膜動脈)の血管壁に浸潤する腫瘍 |
出典:TNM悪性腫瘍の分類(第8版)日本語版.消化器系腫瘍.消化管の高分化型神経内分泌腫瘍-膵臓.TNM分類より作成
N分類
| NX | 所属リンパ節転移が不明 |
| N0 | 所属リンパ節に転移がない |
| N1 | 所属リンパ節に転移 |
出典:TNM悪性腫瘍の分類(第8版)日本語版.消化器系腫瘍.消化管の高分化型神経内分泌腫瘍-膵臓.TNM分類より作成
M分類
| M0 | 遠隔転移がない |
| M1 | 遠隔転移がある |
出典:TNM悪性腫瘍の分類(第8版)日本語版.消化器系腫瘍.消化管の高分化型神経内分泌腫瘍-膵臓.TNM分類より作成
膵NETのステージ分類
| ステージ | T | N | M |
|---|---|---|---|
| 1 | T1 | N0 | M0 |
| 2 | T2、3 | N0 | M0 |
| 3 | T4 | N0 | M0 |
| Tに関係なく | N1 | M0 | |
| 4 | Tに関係なく | Nに関係なく | M1 |
出典:TNM悪性腫瘍の分類(第8版)日本語版.消化器系腫瘍.消化管の高分化型神経内分泌腫瘍-膵臓.TNM分類より作成
消化管NETのステージ分類
消化管NETのステージ分類は、臓器ごとの浸潤の深さと腫瘍の大きさが治療方針と予後に関わるため「胃」「十二指腸」「小腸」「虫垂」「結腸」のそれぞれで分類されています。
悪性度による分類
NENの悪性度は、「分化度」「Ki-67指数」「核分裂像数」により分類されます。前述の通り高分化型はNET、低分化型はNECに分類され、NETは、「Ki-67指数」「核分裂像数」の数値により、G1~G3に分類されます。
ホルモン症状による分類
機能性NETは、ホルモン症状により、「インスリノーマ」「ガストリノーマ」「グルカゴノーマ」「VIPオーマ」「ソマトスタチノーマ」「カルチノイド」の6つに分類されます。関連するホルモンにより、それぞれ特徴的な症状が起こります。
機能性NETのホルモン別症状
| タイプ | ホルモン | 症状 |
|---|---|---|
| インスリノーマ | インスリン | 冷や汗、動悸、意識障害など |
| ガストリノーマ | ガストリン | 胃・十二指腸潰瘍、慢性下痢、腹痛、胸焼け、体重減少など |
| グルカゴノーマ | グルカゴン | 皮膚の発赤を伴った発疹、体重減少、高血糖など |
| VIPオーマ | VIP | 下痢、低カリウム血症、胃酸分泌の低下など |
| ソマトスタチノーマ | ソマトスタチン | 腹痛、体重減少、高血糖、胆石症、脂肪便、下痢など |
| カルチノイド | セロトニン プロスタグランジン ヒスタミン ブラジキニンなど | 皮膚の紅潮、下痢、むくみ、喘息、心不全など |
出典:膵・消化管神経内分泌腫瘍診療ガイドライン2019年【第2版】.診断より作成
遺伝性疾患による分類
膵・消化管NETでは、親から子へ遺伝する可能性がある「遺伝性疾患」が、全体の5~10%で認められます。遺伝性疾患の1つの病態としてNETを発症することがあるため、NETと診断されたことで、遺伝性疾患が発見されることもあります。こうした遺伝性疾患の患者さんをNETの患者さんの中から見つけることは、「治療方針が異なること」、「併発する疾患の早期診断と早期治療を行うため」、そして「リスクのある血縁者の早期診断と早期治療を行うため」に重要です。
- 多発性内分泌腫瘍症1型(MEN-1)
- フォンヒッペル・リンドウ病(VHL)
- 神経線維腫症1型(NF1)/フォンレックリングハウゼン病
- 結節性硬化症(TSC)/プリングル病
主なNETを合併する遺伝性疾患
神経内分泌腫瘍の検査と診断
ホルモン症状がある機能性NETでは、それぞれ特有の症状を調べる検査が行われます。
機能性NETの疑いがある場合は、CT・MRI・超音波などによる画像検査、超音波内視鏡検査・超音波内視鏡下穿刺吸引法による生検、選択的動脈内刺激物注入試験(SASIテスト)、ソマトスタチン受容体シンチグラフィなどが必要に応じて行われます。遺伝性疾患の合併によるNETを鑑別するために、MEN1遺伝子変異のスクリーニング検査も行われます。
非機能性NENは特徴的な症状がないため、超音波検査、CT検査、内視鏡検査で偶然発見されることがあります。膵NENの疑いがある場合は、ダイナミックCT・MRI、造影超音波検査、超音波内視鏡下穿刺吸引法による生検、ソマトスタチン受容体シンチグラフィ、FDG-PET/CTなどの検査が必要に応じて行われ、転移の疑いがあれば追加検査が行われます。
内視鏡検査で消化管NENの疑いがある腫瘍性の病変があれば、内視鏡による生検が行われます。消化管NENと診断された場合は、CT、MRI、ソマトスタチン受容体シンチグラフィなどで転移の有無を調べます。
NETとNECを鑑別するためには、組織検査で「分化度」「Ki-67指数」「核分裂像数」を調べます。分化度は、細胞の形を顕微鏡で調べ、正常の細胞とどの程度異なっているかで、高分化型か低分化型かを判定します。Ki-67指数は、腫瘍から採取した組織を免疫染色してKi67陽性細胞を顕微鏡で観察し、陽性の割合が高い(Ki-67指数の数値が高い)ほど、細胞の増殖スピードが速いと判定されます。核分裂像数も染色された細胞を顕微鏡で観察し、核分裂をしている細胞の個数を調べます。数字が大きいほど、細胞の増殖スピードが速いと判定されます。
| 分類(グレード) | NET G1 | NET G2 | NET G3 | NEC G3(小細胞型/大細胞型) |
|---|---|---|---|---|
| 分化度 | 高分化型 | 低分化型 | ||
| Ki-67指数 | 3%未満 | 3~20% | 20%を超える | 20%を超える |
| 核分裂像数 (/10HPF) | 2未満 | 2~20 | 20を超える | 20を超える |
| 増殖能 | 低い | 高い | ||
| 悪性度 | 低~中悪性度 | 高悪性度 | ||
選択的動脈内刺激物注入試験(SASIテスト)
SASIテストは、インスリノーマやガストリノーマを刺激する働きを持つカルシウムを腫瘍に栄養を届けている動脈に直接注入し、反応性を見ることで機能性NETがその動脈支配領域にあるかどうかを見る検査です。
ソマトスタチン受容体シンチグラフィ
NET G1とG2、一部のNET G3では、ソマトスタチン受容体が高頻度で発現しています。ソマトスタチン受容体シンチグラフィは、この受容体に結合するソマトスタチンの類似物質に、診断用の放射性同位元素「インジウム」を付加した薬剤「ペンテトレオチド(製品名:オクトレオスキャン)を注射して行う画像検査です。ソマトスタチン受容体の発現の有無を調べることで、ソマトスタチン受容体を介した治療薬「ソマトスタチンアナログ製剤」や「放射性核種標識ペプチド療法(PRRT)」などの治療適応を考慮する際にも用いられます。
神経内分泌腫瘍の標準治療
NENは、NETとNECで治療選択が異なります。
NETの治療
NET G1~G3では、手術、局所療法、薬物療法の3つのうちから必要な治療が選択されます。
手術
NET治療の第1選択は、手術です。遠隔転移がある場合でも、手術が考慮されます。また、腫瘍を全て取りきることが困難でも、症状の緩和や予後の改善を目的に減量手術が行われます。
局所療法
NETでは肝転移が多く、全ての転移巣を切除できないことがあります。そうした場合、カテーテルを使った治療や、ラジオ波焼灼術などの局所療法が行われることがあります。
薬物療法
NETの薬物療法では、ソマトスタチンアナログ製剤、分子標的薬、アルキル化剤、放射性核種標識ペプチド療法(PRRT)などが使用されます。
ソマトスタチンアナログ製剤は、機能性NETの症状緩和を目的に使用されていましたが、非機能性NETに対しても抗腫瘍効果があることが臨床試験で確認されたため、膵・消化管NETに対する治療薬として使われています。現在、オクトレオチド、ランレオチドの2剤が保険適用となっています(オクトレオチドは消化管のみに適応)。オクトレオチドは、毎日自己注射または、徐放性製剤を使って月1回の注射で投与されます。ランレオチドは、月1回の徐放性製剤を使って月1回の注射で投与されます。
NETに対して使用される分子標的薬には、エベロリムスとスニチニブの2剤があります。エベロリムスは、NETの細胞増殖に関わる「mTOR」という細胞内のシグナル伝達物質を阻害することで、抗腫瘍効果を発揮する分子標的薬です。腫瘍ができると、そこに栄養を供給するために新たな血管が作られ、これを血管新生と呼びます。スニチニブは、この血管新生の増殖因子の受容体と選択的に結合することで、血管新生を抑制する分子標的薬です。
また、エベロリムスやスニチニブが登場する前から、アルキル化剤「ストレプトゾシン」NETの治療薬として使用されてきています。
NECの治療
NECは、腫瘍の進行度により、手術、薬物療法、放射線治療から必要な治療が選択されます。手術可能なら手術が行われ、必要に応じて術後補助療法として薬物療法や放射線治療が行われます。手術不可能な場合で、遠隔転移がなければ薬物療法と放射線治療が、遠隔転移がある場合は薬物療法が選択されます。
切除不能のNECに対しては、小細胞肺がんの治療として行われている「エトポシド+シスプラチン」併用療法(EP療法)または、「イリノテカン+シスプラチン」併用療法(IP療法)が行われます。
二次治療についても小細胞肺がんの治療指針を参考に、一次治療で行わなかった治療が選択されることが多くありますが、推奨される二次治療はまだ確立されていません。
神経内分泌腫瘍に対する課題と注目の治療
NENに対する注目の治療として、「放射性核種標識ペプチド療法(PRRT)」、マルチキナーゼ阻害薬「スルファチニブ」による治療、「経口タイプのソマトスタチンアナログ製剤」があります。
放射性核種標識ペプチド療法(PRRT)
NENの新たな治療法として放射性核種標識ペプチド療法(PRRT)が注目されています。2021年6月にルテチウムオキソドトレオチド(177Lu)が、「ソマトスタチン受容体陽性の神経内分泌腫瘍」の効能または効果で承認されました。
ルテチウムオキソドトレオチド(177Lu)は、ソマトスタチン類似物質を放射性同位元素のルテチウム177で標識した医薬品です。NENで高発現するソマトスタチン受容体に結合し、ルテチウム177から出る放射線でがん細胞を直接攻撃します。
外照射による放射線治療と異なり、ソマトスタチン受容体を発現しているがん細胞を特異的に攻撃できるため、腎機能や骨髄抑制などに問題がなければ基本的に繰り返し治療が可能です。
治療は、1回30分、2か月に1回、上限4回を1セットとして行われます。ルテチウムオキソドトレオチド(177Lu)は、主に尿として排出されます。日本では、放射線の排出基準があるため、最短1泊2日の入院治療として行われています。
「放射線治療病室」もしくは「特別な措置を講じた病室」での入院治療が必要なため、治療可能な施設が限られており、二次治療以降で治療法がない患者さんに対して実施されているのが現状です。
NECは一般的にソマトスタチン受容体を発現していない場合が多いため、ソマトスタチン受容体を標的とするPRRTは効果が期待できないとされています。一方で、NECでも50%程度の患者さんではソマトスタチン受容体が発現しているという研究報告もあります。NECであっても、ソマトスタチン受容体シンチグラフィを行い、陽性であればPRRTを行うことで40%程度の患者さんでは効果が認められると報告されています。
スルファチニブ
スルファチニブは、「VEGFR」「FGFR1」「CSF-1R」を標的としたマルチキナーゼ阻害薬です。血管新生に関わるVEGFRやFGFR1を阻害しながら、腫瘍周囲の免疫微小環境を調整することで抗腫瘍効果を発揮します。現在、臨床試験が進行中で、結果次第では新たな治療薬として承認される可能性があります。
経口ソマトスタチンアナログ製剤
ソマトスタチンアナログ製剤は、膵・消化管NETに対する治療薬として使われています。現在、使われているのは注射剤ですが、注射針は太いため、痛みなど患者さんの負担が比較的大きい治療です。海外では、経口薬のソマトスタチンアナログ製剤が開発されています。日本でも、近い将来、臨床試験が開始すると思います。
その他にも、現在のPRRTで使用される放射線はβ線ですが、β線より100倍強いα線を使ったPRRTが欧州では開発されています。日本でも数年後には有効性と安全性を確認するための臨床試験が行われるかもしれません。α線を使ったPRRTが実用化されれば、切除不能のNENでも治癒が期待できる患者さんが増える可能性がありそうです。
治療により環境に排出される放射線量は微々たるものなので、米国では、PRRTは外来で、多くの患者さんに対して行われています。日本は、放射線の排出基準が厳しいため、今のところ特別な施設での入院が必要となり、限られた患者さんにしか実施できていません。制度など、今後の改善を期待したいところです。
プロフィール
肱岡 範(ひじおか すすむ)
2007年 熊本赤十字病院 消化器科 医員
2009年 愛知県がんセンター中央病院消化器内科 医長
2017年 国立がん研究センター中央病院肝胆膵内科 医長
2018年 国立がん研究センター中央病院希少がんセンター併任

