光によるがん治療「光線力学療法」-埋め込み型発光デバイスの開発で広がるがん治療の可能性

2019.1 取材・文:町口充
光でがんを治療する光線力学療法(Photodynamic Therapy:PDT)が今、改めて注目されています。光線力学療法は、病巣部分に光増感剤を集積させ、そこに光を照射することにより発生する活性酸素でがんを死滅させる治療法です。低侵襲で、なおかつ正常細胞を傷つけずにがん細胞のみを破壊します。現在、光の照射は主に、肺や食道などのがんの近くに挿入した内視鏡で行われていますが、昨年、体内埋め込み型の発光デバイスが開発されました。この発光デバイスは無線で給電して弱い光を長時間照射できるため、腫瘍と光源のズレを最小限にし、深部の臓器のがんにも活用できる次世代型の光線力学療法として期待が高まっています。
光線力学療法のしくみ
光線力学療法とは、感光物質(光増感剤) がもつ光増感作用を利用した治療法です。
原理を考えるうえでわかりやすい例が写真の技術です。現在はデジタルカメラの時代ですが、かつて主流だったのはフィルムカメラです。フィルムカメラは「銀塩カメラ」とも呼ばれましたが、これはカメラのフィルムが銀のハロゲン化合物であるハロゲン化銀を感光用の物質として使っているためです。ハロゲン化銀は光を吸収すると化学変化を起こし、フィルム上に画像パターンをつくります。
銀塩カメラ用のフィルムや印画紙といった写真感光材料の感光性を高めるための処理が光増感であり、光量が小さくても感光するようにしたり、感光色素を添加して増感作用を強めるなど、さまざまな方法があります。
このような銀塩写真における光増感作用と同じ基本原理で作用するのが光線力学療法です。
光線力学療法では、治療の最初にまず光に感受性をもつ光増感剤を患者さんの血管内に注入します。光増感剤は第1世代がフォトフリン(一般名:ポルフィマーナトリウム)、第2世代はレザフィリン(一般名:タラポルフィンナトリウム)と呼ばれる薬剤(ポルフィリン誘導体)を用いています。色素化合物であるポルフィリンは光を強く吸収するという特性があり、生体適合性に優れ、体への害はほとんどありません。
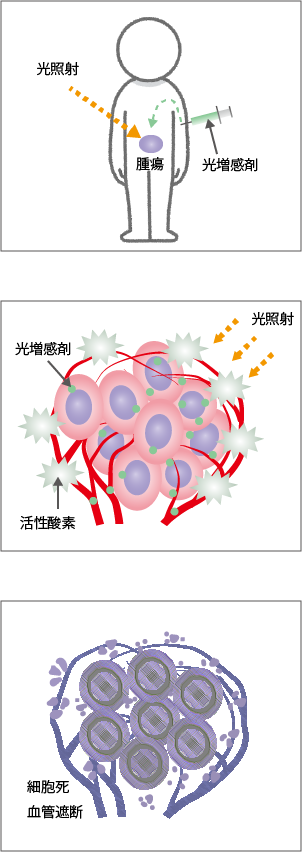
光増感剤は血流に乗って全身の細胞に取り込まれますが、投与後、正常細胞からは容易に排泄される一方でがん細胞には長くとどまるという性質があります。この時間差を利用して、注入から一定時間をおいたのちに光増感剤ががん細胞に集積しているころを見計らって光を当てます(図1参照)。
光線力学療法で主に用いられる光はレーザー光です。内視鏡を通して光ファイバーを肺や食道などに挿入し、がん細胞をねらってレーザー光を照射する方法がよく行われます(図2参照)。
上:がんに集まる性質をもった光増感剤を静脈注射する
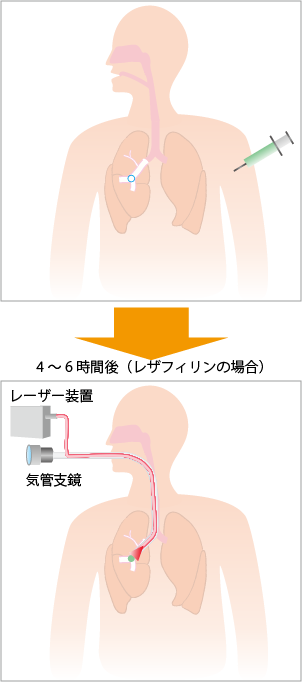
下:気管支内視鏡を使って、レーザー光をがんに照射する
照射されるレーザー光の出力は1cm2あたり0.1W(ワット)で、10~20分間ほど照射します。レーザーで治療すると聞くと高出力のレーザーで病巣を焼き切るイメージがありますが、光線力学療法で使うレーザーは低出力であるため手をかざしてもほとんど熱さを感じないくらいのエネルギーです。それだけではがん細胞にダメージを与えることはなく、正常細胞に当たっても副作用や害はほとんどありません。
照射された光は光増感剤に含まれる色素と反応して光化学反応を起こします。すると、そのエネルギーががん組織内の酸素を変化させ、活性酸素を発生させます(図1参照)。活性酸素はがん細胞に傷害を与えるとともに、がん組織を取り巻く血管も傷害してがん細胞へ栄養が送られないように血流を遮断することで、がん細胞を壊死させます(図1参照)。活性酸素は、体の老化や動脈硬化、糖尿病、さらにはがんなど多くの病気の原因ともいわれていますが、この活性酸素の性質を逆手にとってがんを殺す治療法が光線力学療法なのです。
光線力学療法の対象と副作用
光線力学療法の歴史をさかのぼると、1978年に米国のトーマス・ドハティー博士らが、レーザーによる光線と、その光に反応して腫瘍に集まりやすい薬剤としてフォトフリンを使った光線力学療法の臨床治験を開始したのが最初とされます。日本ではいち早く研究に着手した東京医科大学では世界に先駆けて肺がんの患者さんに対する内視鏡と併用した光線力学療法に成功しました。
1994年には、早期肺がん(病期0期または1期)、表在型食道がん、表在型早期胃がん、子宮頸部初期病変(初期がん、異形成)に対する光線力学療法が保険適用となりました。対象は、手術などの根治的治療が不可能な場合や、肺や子宮頸部の機能温存が必要で他の治療法が行えない場合に、内視鏡で病巣全容が観察できてレーザー光照射が可能な患者さんです(表1参照)。これらの疾患に対する従来の治療に比しても同等以上の良好な成績をおさめています。
- 早期肺がん(0期、I期)
- 表在型食道がん
- 表在型早期胃がん
- 子宮頸部初期がん、および異形成
- 進行がんなどによる気道狭窄など
- 原発性悪性脳腫瘍
- 局所遺残再発食道がん(化学放射線療法、または化学療法後)
表1 光線力学療法の保険適用疾患
治療にあたって投与される光増感剤は、肝臓や腎臓から代謝・排出され、毒性もほとんどないので安全ですが、唯一ともいえる副作用として光線過敏症があります。光線過敏症は、体内に残った光増感剤が太陽光に反応して起きるものです。太陽光にさらされた皮膚に赤みや炎症、かゆみを伴う皮疹(発疹)が現れます。なかでもフォトフリンは水に溶けにくい薬剤であるため、脂肪組織などに取り込まれて体内に長時間残ってしまいます。このため、フォトフリンの投与後は少なくとも1か月間は直射日光を避けて、薄暗い室内(100~300 lx:ルクス)で過ごすようにします。
こうした副作用を軽減しようと登場したのが、第2世代の光増感剤レザフィリンです。これは水に溶けやすい性質であるため排出されるのも早く、直射日光を避ける期間は2週間必要ないほどです。その間は遮光カーテンなどを用いて500 lx以下に調整した室内で過ごすことが勧められています。蛍光灯をつけた事務所内の明るさの目安が400~500 lxといわれますから、室内では普通の明るさで生活することができます。また、必要に応じて日焼け止めクリームの塗布も有効です。
光線力学療法―悪性脳腫瘍・遺残再発食道がんの治療成績
光線力学療法で用いられるレーザー光は波長が630~670nmの赤色光ですが、光増感剤を活性化させるレーザー光は生体ではせいぜい5mmぐらいの深さまでしか到達できません。
このため、1994年に保険適用となった光線力学療法は内視鏡が届く範囲の表在性のがんに限られています。これらのがんは、単発で早期のがんであれば光線力学療法で治療しなくても外科手術や内視鏡治療によって完治切除できることが多いと考えられます。それなのになぜ光線力学療法が保険適用となったかというと、高齢だったり、ほかの病気を抱えているため手術が難しいとか、どうしても手術は受けたくないという患者さんに対して有効と判断されたためです。しかし、適応となる患者さんが限られているため光線力学療法はあまり普及していませんでした。
そんな光線力学療法が改めて注目されるようになったのは2000年代に入ってからです。
社会の超高齢化が進むなかで、手術など侵襲的な治療ができないというケースがますます増えてきました。さらに、がんは再発することが多く、その場合は通常、手術は適応となりません。そこで、外科的に治療できないケースに対して完治は無理でも延命のために、光線力学療法は有効な治療法と考えられました。
2010年に、進行がんなどによる気道狭窄などに対する光線力学療法が保険適用となり、2013年には原発性悪性脳腫瘍、2014年には化学放射線療法または放射線療法後の局所遺残再発食道がんが保険適用となっています。
進行した肺がんでは、気管や左右の太い気管支ががんによって狭くなることがあります。こうなると呼吸困難を引き起し、完全に塞がってしまえば死に至る恐れがあります。この場合、手術で切除できればいいですが、進行肺がんでは肺機能が低下していたりして手術ができないことが多いのです。少しでも症状を軽減するための処置として光線力学療法は適しています。
脳における悪性腫瘍では、がんのある部位と正常な部位との境界がわかりにくく、また、病巣を十分に摘出するには、たとえば言葉を話す中枢まで切除しなければならないなど、患者さんのQOL(生活の質)を著しく損う場合があります。そのような場合、手術によって言語中枢を残し、かつ最大限にがん組織を摘出したあと、がんが残存している部分を光線力学療法で治療し、機能温存を図る方法があります。光線力学療法は手術前に光増感剤を投与して手術中に開頭した状態で、がんがある部分に直接レーザー光を当てて治療します。
食道がんにおいても、患者さんの高齢化により外科手術が難しい症例が増加し、化学放射線療法あるいは放射線療法を行うケースが増えています。こうした治療は臓器や機能を温存できるメリットがありますが、切除によってすべてのがんを取り切るわけではないので、がんが残ったり(遺残)、いったんは効果がみられても再発することもあります。この状態になると放射線や化学療法などの同じ治療を繰り返すのは難しくなるため、光線力学療法が適応となるのです。
これら疾患に対する光線力学療法の効果は目を見張るものがありました。悪性脳腫瘍では、術後に放射線治療と化学療法を行う標準治療のみの場合は、1年生存率が61%なのに対して、標準治療に光線力学療法を加えた治療では、1年生存率は95.5%、うち、初発膠芽腫については100%でした。2年間の無増悪生存率(PFS)は、48.8%とめざましい成績を示しています。
また、化学放射線療法、または放射線療法後の局所遺残再発食道がんに対する臨床試験では、88.5%に完全奏効が得られ、特にがんが粘膜下層までにとどまる病変(T1)では、100%の完全奏効を示しています。
次世代型光線力学療法-深部臓器がんでの可能性
このように光線力学療法は最近になって見直されていますが、脳腫瘍のようなケースは別として、光線力学療法による治療が可能なのは内視鏡が届く範囲であるため、肝臓や腎臓、膵臓など体の奥にある深部臓器は治療の対象にはならないという問題があります。
そこで新たに開発されたのが、内視鏡を用いるのではなく、生体内の臓器や組織上にシールのように貼って長期間安定的に固定できる体内埋め込み型の発光デバイスを用いて光を照射する次世代型の光線力学療法です。
この開発を行ったのは、早稲田大学高等研究所の藤枝俊宣准教授(現在、東京工業大学)と防衛医科大学校の守本祐司教授を中心とする研究グループです。デバイスの開発は早稲田大、生体応用は防衛医大が担当して行った医工連携の共同研究です。
研究グループがまず着目したのは、従来型の光線力学療法とは違う「メトロノミック光線力学療法」でした。メトロノミックとはメトロノームと同義語で、絶え間なくリズムを刻むメトロノームのように治療するという意味です。例えば、「メトロノミック化学療法」とは低用量の抗がん剤を休みなく長期間投与する方法をいいます。同様にして、出力が非常に低く弱い光を長時間照射するのがメトロノミック光線力学療法です。
従来の光線力学療法における光照射条件は、光の強度が1cm2あたり0.1Wで、照射時間は10分間くらいです。これはエネルギーに換算すると1cm2あたり100J(ジュール)のエネルギーになります。つまり、総量として100Jの光エネルギーが到達すれば治療効果が現れると考えることができます。
光エネルギーの値は光強度×時間で求められるので、光強度を弱く照射時間を長くしても100Jに達すればよいことになります。この考え方から、2000年代になってから提唱されるようになったのが「メトロノミック光線力学療法」です。光強度を極端に低くして従来の1000分の1ぐらいの0.0001Wにし、そのかわり照射時間を1000倍の10,000分、つまり7日間あまりにします。つまり0.0001Wの微弱な光を7~8日間照射し続けます。すると0.0001W×10,000分で100Jになります。
7日も8日も光を当て続けるとなると内視鏡での照射は不可能で、手術中に行うこともできません。そこから発想されたのが光源を体内に埋め込む方法です。
光線力学療法―体内埋め込み型発光デバイスの開発
体内埋め込み型の医療用デバイスは、さまざまな疾患向けに研究され、埋め込み型心臓除細動器やペースメーカー、人工内耳、パーキンソン病の脳深部刺激療法(DBS)、糖尿病のインスリンポンプ療法などのように、すでに臨床で活用されています。
光線力学療法では、光源ががん組織のある部位と少しでもずれると光ががん組織にあたらなくなるので治療効果は見込めなくなります。このため、光源を埋め込むにしてもいかに安定して固定させるかが大きな課題でした。固定には臓器に縫い付ける方法や、生体糊を使う方法もありますが、脳や肝臓など軟らかい臓器や、腸管のように蠕動運動などで動く臓器では、どちらも現実的ではありません。
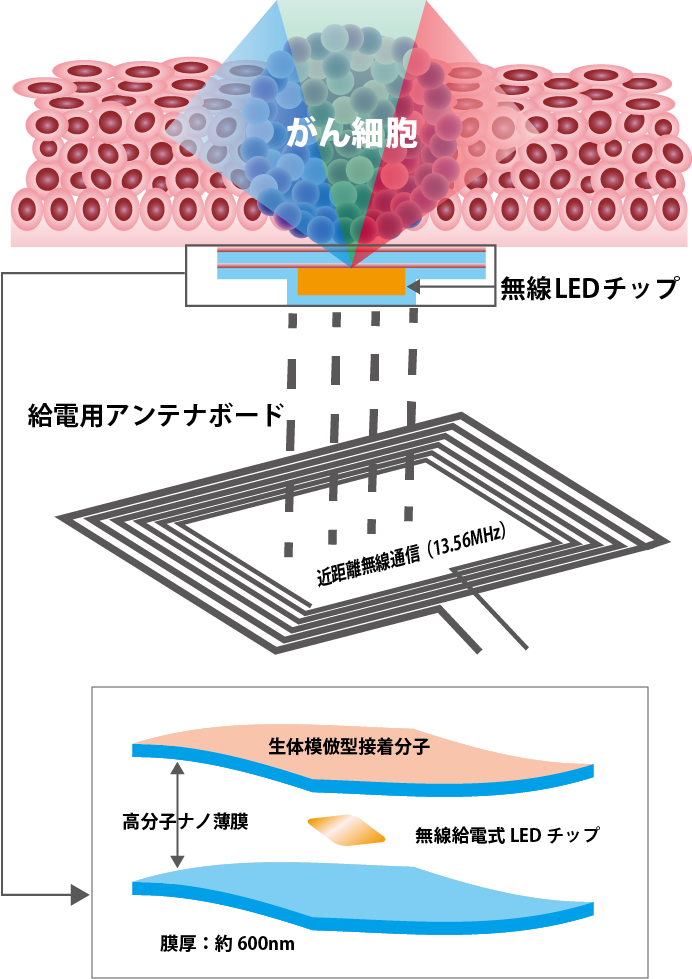
そこで研究グループは、生体内の組織表面にシールのように貼り付けられる無線給電式発光デバイスを開発しました。ここにはさまざまな技術が集積しています。
生体組織への安定した接着を実現させるために考え出されたのが、柔軟性や伸縮性に優れるシリコーン性の高分子ナノ薄膜の表面に、ポリドーパミンと呼ばれる接着性が格段に高い高分子をコーティングすることでした。
高分子ナノ薄膜は厚さが約600nmです。1nmは100万分の1mmですから、大変な薄さです。膜が薄くなるほど接着性や粘着性が増すといわれていて、強度も強く、1円玉を26枚乗せても破れることはありませんでした。この高分子ナノ薄膜だけでも貼り付ける力を持っているのですが、生体内のように臓器から液体が浸み出ているような場所では効果が弱まってしまいます。水分があるとどうしても粘着力が弱くなるのです。
そこで、濡れた臓器への接着性を高めるために用いたのがポリドーパミンです。ポリドーパミンは、イガイの仲間でムール貝が分泌する接着タンパク質の分子構造を模して合成された生体模倣型接着性高分子です。海辺の岩場とか船の底にびっしりとへばりついたムール貝の集団を見ることがありますが、どんなに荒波にもまれてもはがされない天然接着剤を分泌しているのがムール貝であり、自然界から学んだ技術というわけです。
光線力学療法―体内埋め込み型発光デバイスの実験結果
光源として選んだのはLEDです。内視鏡を用いた光線力学療法ではレーザー光が使われますが、メトロノミック光線力学療法では光強度はかなり弱くてよいため、小型で薄いLEDチップを活用しました(図3参照)。これを高分子ナノ薄膜2枚の間に挟み込んでいます(図4参照)。

出典:(左)Yamagishi K, et al: Biomater Sci, 2019. (DOI: 10.1039/C8BM01290C)
(中央、右)Yamagishi K, et al: Nat Biomed Engineer, 2018. (DOI: 10.1038/s41551-018-0261-7)
体内に埋め込んだLEDへの電力の供給はどうするかというと、ここで採用されたのが「Suica(スイカ)」「PASMO(パスモ)」などの非接触ICカードの技術です。非接触ICカードとは文字通り「触らずに読み取りが可能なカード」ということです。電磁界や電波などを用いた近距離無線通信で情報をやりとりする技術が使われていて、SuicaやPASMOは自動改札機にカードを近づけるだけで読み取りが可能となります。
同様にして、体内に埋め込んだ発光デバイスには、近距離無線通信の技術を利用して無線給電用アンテナから電力を送ってLEDを点灯させます。そして、あらかじめ投与しておいた光増感剤に向け光を照射して治療します(図4参照)。
マウスを使った実験では、がんを移植したモデルマウスの皮下に、前述のLEDチップによる無線発光デバイスを貼り付けて固定しました。光増感剤であるフォトフリンを静脈注射したあと、マウスの飼育箱の下に設置した無線給電用アンテナからLEDに電力を送り、発光デバイスを10日間連続的に点灯させました(図5参照)。

背中の皮内に腫瘍細胞を移植したマウス。ケージの底に配置されたアンテナボードから給電し、皮下に埋め込んだ発光デバイスが光っている。デバイスがアンテナから4cm以上離れても給電可能。
この実験では緑色光と赤色光が使われましたが、いずれの光でも腫瘍は顕著に縮退し、特に緑色光を使ったマウスでは10個中6個の腫瘍が完全に消失しました。
緑色光と赤色光を比べると波長は赤色光のほうが長く、生体の深部に到達するには赤色光のほうがまさっています。それなのになぜ赤色光より緑色光のほうが治療効果が高かったかというと、理由として考えられるのはメトロノミック光線力学療法ゆえの効果です。
従来の光線力学療法では光の照射は10分間ですが、光が到達するのは5mmぐらいの深さまでで、それ以上深いところにあるがんには効果が望めません。メトロノミック光線力学療法だと10日間程度、光を当て続けます。すると、波長が短く表層にしか届かない緑色光であっても、時間を経て死滅したがんがはぎ取られていくので、「掘り下げ効果」によって5mmよりさらに深いところまで光が達するようになるかもしれません。また、赤色光より緑色光のほうが光をより強く吸収するため、活性酸素をより多く発生させている可能性もあります。
光線力学療法―次世代型の臨床試験に向けて
埋め込み型発光デバイスを使ったメトロノミック光線力学療法のメリットは、1つには臓器を選ばないことでしょう。埋め込みには手術が必要なため、内視鏡のように簡単に病巣の部位までアクセスできるわけではありませんが、基本的には体の中のどの場所にも埋め込みが可能です。特に、内視鏡ではアクセスできない肝臓や腎臓、膵臓などの深部組織を治療できるのは大きな利点です。
また、照射点がずれないため、安定した効果が得られるメリットもあります。肺や消化管は呼吸や蠕動運動などで終始動いているため、内視鏡を使って光を照射しようとしてもどうしても照射点にズレが生じます。すると、光エネルギーに強弱が生じ、弱すぎれば効果が減弱、強すぎれば熱傷害が出ることもあります。
さらに、照射する光の波長に制限がないのもメリットとしてあげられます。従来の光線力学療法は赤色光に限定されていますが、マウスの実験で明らかになったように治療効率が高いのは緑色光です。メトロノミック光線力学療法では光源とがんとの距離が近く、どのような色の光でも使える可能性があるため選択肢が広がります。
埋め込み型メトロノミック光線力学療法は現段階ではまだ動物実験の段階で、今後、患者さんを対象とした臨床試験が期待されています。発光デバイスを埋め込む方法は、マウスの実験では開腹手術で行われましたが、将来的に臨床応用が実現すれば、腹腔鏡のような開腹手術より侵襲の少ない方法が可能になるでしょう。
ベッドの下にアンテナボードを敷いて、家庭内で寝ているときだけ治療を受ける方法なども検討されれば、入院して治療を受けなくても、通常の日常生活を送りながら治療を受けることができるようになるかもしれません。
プロフィール
守本祐司(もりもとゆうじ)
1990年 陸上自衛隊第一衛生隊医官
1994年 陸上自衛隊久里浜駐屯地医官
1998年 米国ライス大学客員研究員
2000年 名古屋市立大学医学部生理学第一講座客員研究員
2001年 防衛医科大学校医用電子工学講座助手
2007年 防衛医科大学校分子生体制御学講座准教授
2018年 防衛医科大学校生理学講座教授

