筋層浸潤性膀胱がんに対するペムブロリズマブ+化学放射線療法の治験
治験の募集状況は、「jRCT 臨床研究等提出・公開システム![]() 」ページでご確認ください。
」ページでご確認ください。
治験名
KEYNOTE-992
筋層浸潤性膀胱がん患者さんを対象に、MK-3475と化学放射線療法の併用療法と化学放射線療法単独療法の有効性および安全性を比較する無作為化プラセボ対照二重盲検第3相試験
治験概要:
筋層浸潤性膀胱がんに対する治験。転移がなく化学放射線療法が適応となる患者さんが対象です。
ペムブロリズマブ+化学放射線療法とプラセボ+化学放射線療を比較して、有効性と安全性で評価する臨床試験です。
登録予定数は、636人。
フェーズは、第3相臨床試験。
試験デザインは、無作為化、並行群間、多施設共同、二重盲検(社内盲検を含む)。
試験群:ペムブロリズマブ+化学放射線療法
対照群:プラセボ+化学放射線療
無イベント期間、有害事象発現数、全生存期間、無転移生存期間などで評価します。
疾患解説:膀胱がん
疾患の詳細は、「膀胱がんを知る」を参照ください。
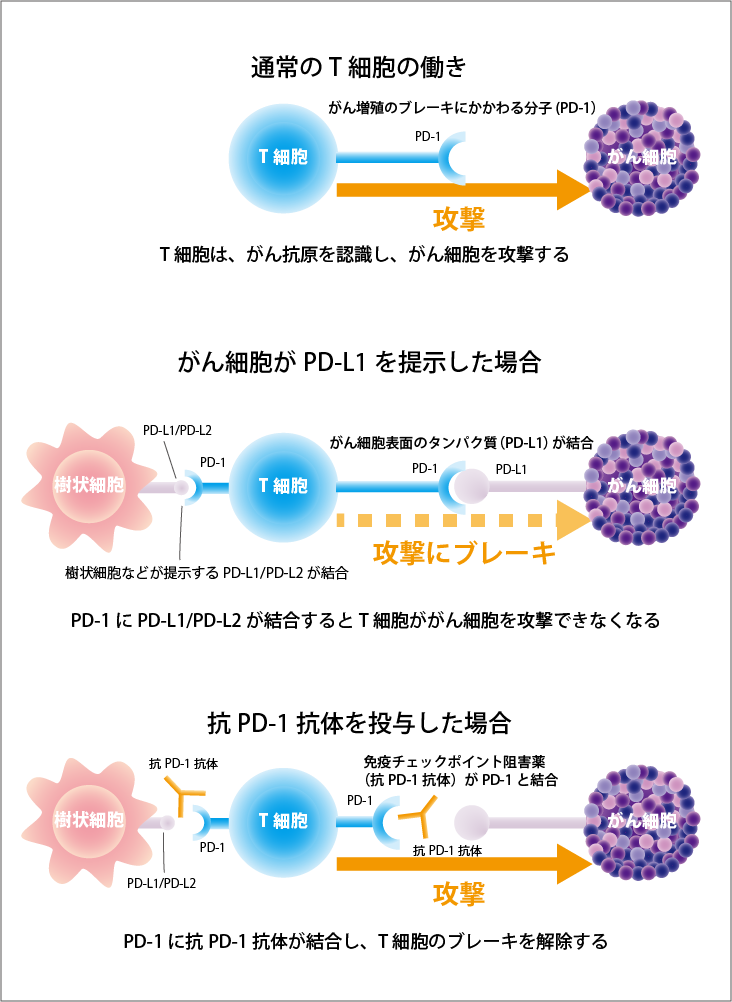
治験薬:ペムブロリズマブ
ペムブロリズマブは、抗PD-1抗体という免疫チェックポイント阻害剤の1つです。
免疫チェックポイント阻害薬は、がんに対して、免疫細胞が本来の力を発揮できるようにする薬です。最終的には、免疫の力でがんを攻撃し、治療効果を発揮します。
がん細胞の表面に発現しているPD-L1とがん細胞を攻撃する免疫細胞(T細胞)に発現しているPD-1が結合すると、免疫細胞は、がん細胞を攻撃しなくなってしまいます。この仕組みを「免疫チェックポイント機構」といい、この仕組みが働かないように開発されたのが、免疫チェックポイント阻害薬です。
治験薬:シスプラチン
シスプラチンは、細胞増殖に必要なDNAと結合して、DNAの複製を阻害したり、がん細胞のアポトーシス(細胞死)を誘導することで抗腫瘍効果を発揮する抗がん薬です。
薬の構造中に白金(プラチナ)があるため、白金製剤やプラチナ製剤とよばれることもあります。シスプラチンは、第1世代の白金製剤です。
治験薬:フルオロウラシル
フルオロウラシルは、DNAの合成阻害、RNAの機能障害によるがん細胞を細胞死に誘導する代謝拮抗薬です。
DNAを構成する主な成分はピリミジン塩基といわれ、アデニン、グアニン、シトシン、チミン、ウラシルなどです。フルオロウラシルは、このピリミジン塩基と似たような構造で、DNAが合成されるときにピリミジン塩基の代わりに取り込まれることで、DNA合成を阻害することで、がん細胞の増殖を抑制します。
治験薬:マイトマイシンC
マイトマイシンCは、抗腫瘍性抗生物質に分類される抗悪性腫瘍薬です。
様々な酵素により還元され複数の活性代謝となることで、DNAの分裂阻止やDNA鎖切断などによってDNAの複製を阻害し、抗腫瘍効果を発揮します。
治験薬:ゲムシタビン
ゲムシタビンは、細胞の増殖に必要なDNA合成を阻害する代謝拮抗薬(ピリミジン拮抗薬)と呼ばれる抗がん剤です。
細胞増殖に必要なピリミジン塩基という物質が必要で、DNAが合成されるときピリミジン塩基と似た構造のピリミジン拮抗薬が代わりに取り込まれることで抗腫瘍効果を発揮します。
ピリミジン系抗がん剤には、ゲムシタビンのほか、フルオロウラシル、テガフール・ギメラシル・オテラシルカリウム配合剤、シタラビン、カペシタビンなどがあります。
ゲムシタビンは、細胞内で代謝され、DNA合成を直接的、間接的に阻害します。
治験情報に関する注意点
治験は、治療を兼ねた臨床試験のことです。薬の元となる物質を動物実験などで有効性や安全性を確認した上で、ヒトに対して使用しても同様に安全で治療効果が予測されるもので行われますが、治験の時点ではまだ有効性や安全性が十分に確認できているわけではありません。有効性や安全性が科学的に証明された治療が、標準治療で、新しい治療が必ずしも最良の治療ではないということを理解してください。その一方で標準治療が確立していない、または薬の耐性ができ、効果が期待できる薬がなくなった患者さんにとって治験は新しい治療選択となる可能性もあります。
治験は「ヘルシンキ宣言」に基づく倫理的原則と、「医薬品の臨床試験の実施に関する基準(GCP)」を遵守して行われています。これにより、治験に参加される方の利益が損なわれることがないよう、安全な手続きで治験は進められます。
治験情報を探すとき、治験を受けたいと思ったときは、まず治験とはどのようなものなのかを理解してください。
がんの治験情報をお探しの方に知ってほしい5つのこと
※ここに掲載した情報は、jRCT 臨床研究等提出・公開システム に登録された情報を元にし、がんプラスが独自に記事としてまとめ、提供しています。
※QLife「がん治験情報サービス」でご案内している治験とは異なります。
試験概要詳細
| 試験の名称 | 筋層浸潤性膀胱癌(MIBC)患者を対象に、MK-3475と化学放射線療法(CRT)の併用療法と化学放射線療法単独療法の有効性及び安全性を比較する無作為化プラセボ対照二重盲検第III相試験(KEYNOTE-992) |
| 試験の概要 | 本治験は、筋層浸潤性膀胱癌(MIBC)患者を対象に、MK-3475の併用化学放射線療法を化学放射線療法単独と比較する 主な仮説は、MK-3475+CRTはプラセボ+CRTと比較して、BI-EFSにおいて優越性を示す |
| 疾患名 | 筋層浸潤性膀胱癌 |
| 試験薬剤名 | ペムブロリズマブ+CRT |
| 用法・用量 | MK-3475 400mgを6週間間隔で投与 化学療法は、以下の3つのレジメンのうちいずれか1つを選択する(放射線療法中に投与) シスプラチン(35mg/m2週1回) 5-FU(500mg/m2)+MMC(12mg/m2) 5-FU:放射線療法の1~5日目及び22~26日目に静脈内投与 MMC:放射線療法の1日目に静脈内投与 ゲムシタビン(27mg/m2週2回) 放射線療法は、以下の3つのレジメンのうちいずれか1つを選択する 通常分割照射(膀胱のみ)64Gy 通常分割照射(膀胱及び骨盤リンパ節)64Gy 寡分割照射55Gy |
| 対照薬剤名 | プラセボ+CRT |
| 用法・用量 | プラセボ 6週間間隔で投与 化学療法は、以下の3つのレジメンのうちいずれか1つを選択する(放射線療法中に投与) シスプラチン(35mg/m2週1回) 5-FU(500mg/m2)+MMC(12mg/m2) 5-FU:放射線療法の1~5日目及び22~26日目に静脈内投与 MMC:放射線療法の1日目に静脈内投与 ゲムシタビン(27mg/m2週2回) 放射線療法は、以下の3つのレジメンのうちいずれか1つを選択する 通常分割照射(膀胱のみ)64Gy 通常分割照射(膀胱及び骨盤リンパ節)64Gy 寡分割照射55Gy |
| 試験のフェーズ | フェーズ3/phase3 |
| 試験のデザイン | 無作為化、並行群間、多施設共同、二重盲検(社内盲検を含む) |
| 目標症例数 | 636 |
| 適格基準 |
|
| 除外基準 |
|
| 主要な評価項目 | 有効性/efficacy |
| 主要な評価方法 | BI-EFS:無作為割付けから特定のイベントの発現が最初に記録されるまでの期間 |
| 副次的な評価項目 | 安全性/safety 有効性/efficacy |
| 副次的な評価方法 | 有害事象を発現した患者数 有害事象により治験治療を中止した患者数 OS:無作為割付けからあらゆる原因による死亡までの期間 MFS:無作為割付けからリンパ節転移又は遠隔転移の所見が最初に記録されるまでの期間など |
| 予定試験期間 | 2020年8月31日~2027年2月10日 |
出典:臨床研究等提出・公開システムより

