がん悪液質に対する治療法開発の取組みが進む ――薬物療法では良好な成績も
2019.11 提供●がんサポート
がん悪液質(Cancer cachexia)は、がん患者に多くみられる合併症の1つ。とくに進行した消化器がんや肺がんで高頻度に発症する。主な症状は、体重減少、骨格筋量減少、食欲不振などで、QOL(生活の質)の低下、予後不良の要因となる。標準治療は確立していないが、病態の解明が進むに従って、治療法開発に向けての取組みが活発になっている。そうした現状を、国立がん研究センター東病院肝胆膵内科医長の光永修一さんに聞いた。
がん悪液質の発症メカニズムが明らかに
がん悪液質は「通常の栄養サポートでは完全に回復することができず、進行性の機能障害に陥る、骨格筋量の持続的な減少を特徴とする多因子性の症候群」と定義される。
原因は完全には解明されていないが、最近の研究で全体像が少しずつ見えてきた。その要因の1つとみられるのは、がん細胞から分泌される「サイトカイン」と呼ばれる生理活性物質だ。本来、サイトカインは外敵から身を守る免疫システムの中で、情報伝達の役割を果たしている。しかし、がんになるとこのサイトカインが過剰に産生されることがある。中でもIL(インターロイキン)-1、IL-6、TNF(腫瘍壊死因子)-αなどの炎症性サイトカインが増え過ると、全身性の炎症が起こり、タンパク質や脂肪の分解が進む。骨格筋など全身の筋肉はタンパク質でできているため、分解が進行するにつれて筋肉量が減り、だんだんと痩(や)せてくる。
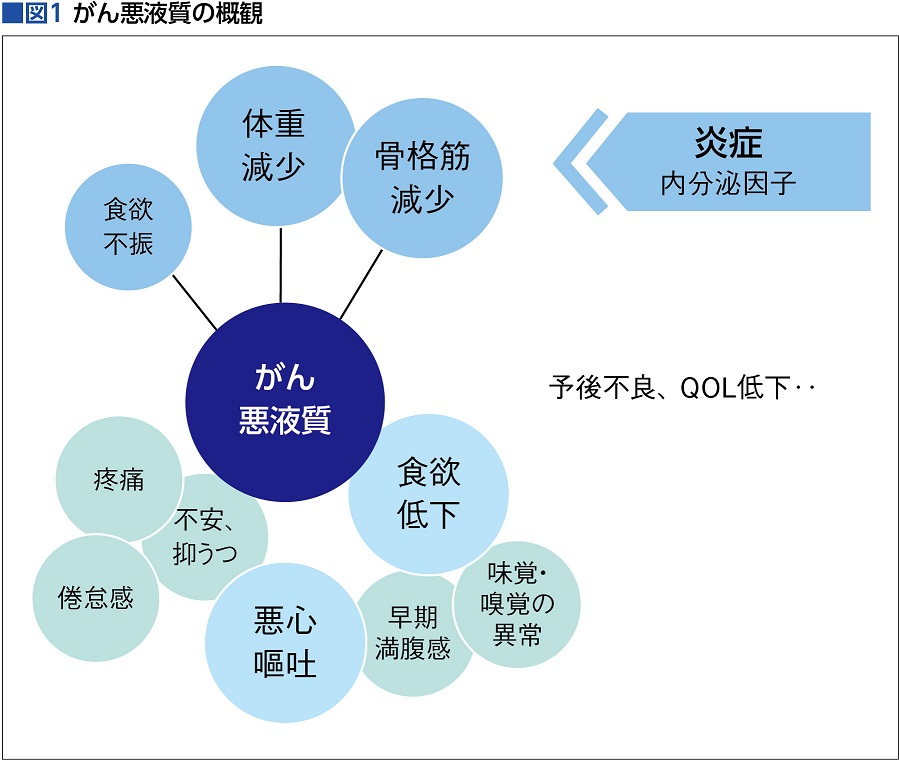
光永さんによると、がん悪液質の典型的な症状は、体重減少、骨格筋量減少、食欲不振で、それに付随して倦怠感、疼痛、不安・抑うつなどが起こる。さらに、悪液質があると、抗がん薬の効果が弱まったり、副作用が増えたり、治療の中断に至ることも。そして、こうした要因が重なることで、QOLや予後に悪影響が及ぶ(図1)。また、悪液質はどんな種類のがんでもみられるが、とりわけ胃がん、大腸がん、膵がんなどの消化器がんや肺がん(非小細胞肺がん)で発症頻度が高いという。
「がん悪液質がどうして起こるのか、詳しいメカニズムはまだ明らかにされていませんが、徐々に解明が進んでいます。最近の研究では、がんに伴ってまず脂質の代謝障害が生じ、その後タンパク質の分解が進むのではないかというデータも示されています。このように、機序が少しずつ見えてきたところで、次に期待されるのが治療法の開発です。がん悪液質は予後を不良にする大きなファクター(因子)ですが、これをコントロールすることによって、がん患者の臨床経過を総合的に改善できる可能性があるからです」(光永さん)
診断基準が明確に
では日常臨床の中で、がん悪液質をどう診断していくのか。がん悪液質の存在は以前から認識されていたが、明確な診断基準はなかった。このため現場では、医療従事者がそれぞれも経験の中で病態を判断し、個々に対応していた。
国際的なコンセンサス(合意)に基づいて、診断基準が作成されたのは2011年のこと。EPCRC(European Palliative Care Research Collaborative:欧州緩和ケア共同研究)のガイドラインを公表し、現在それが世界の診断基準のスタンダード(標準)となっている。
このガイドラインでは、悪液質を「前悪液質」、「悪液質」、「不応性悪液質」の3ステージに分け、このうち悪液質については、次のような診断基準を提唱している。
①過去6カ月間における5%以上の体重減少
②2%以上の体重減少、かつBMI(Body Mass Index:体格指数)が20未満、
③2%以上の体重減少、かつ骨格筋量が減少
この3条件のいずれかに一致し、経口摂取不良、全身炎症を伴えば悪液質とみなされる(図2)。
光永さんも「国際的なコンセンサスにより診断基準が明確になったのは大きな前進。これによって、共通の基盤でがん悪液質の診断が可能になった」と高く評価が、一方で、この基準だけでがん悪液質をみなすのは、現実的に難しいところがあるとも指摘する。
がん患者は抗がん薬や副作用の影響もあって、多くの場合、体重が減少する。過去6カ月以内の体重減少が5%以上を悪液質とすると、大半がこのカテゴリーに入ってしまう可能性があるからだ。このため実臨床では、EPCRCの基準を踏まえた上で、Evans(エヴァンス)分類という別の基準も参考に診断を下すことが多いという。
エヴァンス分類は、食欲不振、倦怠感、臨床検査値の異常(炎症反応、アルブミン値、貧血)、骨格筋量の減少、筋力低下の5項目のうち3つ、それに体重減少を組み合わせて悪液質を診断する。
「例えば、体重が減っていても、炎症反応が起こっていなかったり、貧血がない場合には、悪液質とは別の原因が考えられます。EPCRCの基準はシンプルなので、より具体的なエヴァンス分類を加味して、がん悪液質かどうかを判断しているのが実情です」(光永さん)
がん悪液質の診断でもう1つ鍵(カギ)となるのが骨格筋量の測定だ。現時点では、二重エネルギーX線吸収法(DEXA:デキサ)がゴールド・スタンダードといわれる。DEXAは骨粗しょう症の診断に広く用いられているが、どこの施設にでもあるものではなく、経時的に測定するのが難しい。そこで代替案として有望なのが、CTを撮像し、腰椎3番レベルの断層画像から骨格筋量が減っているかどうかを判定する方法だ。
光永さんは「骨格筋量の変化を知ることは、がん悪液質を診断する上でとても大事。装置がネックとなるが、がん診療では、治療効果をみるために定期的にCT検査を行うことが多いく、そのついでに骨格筋量も調べられる。今後はCTによる骨格筋量の測定が主流になっていくのではないか」と話す。

薬物療法で食欲不振や体重減少が改善
一方、がん悪液質の治療。残念ながらまだ標準治療は確立していない。しかし、病態の解明が進んだことから、治療法開発に向けた取組みに拍車がかかっている。
中でも有望視されているのが、グレリン受容体に作用する「アナモレリン」という薬剤だ。グレリンは胃から分泌され、食欲を促進する内因性のホルモン。食欲を増すだけでなく、抗炎症作用、筋肉のタンパク質が分解されるのを抑制する作用、脂肪の蓄積を増加する作用なども併せ持つ。アナモレリンはグレリンと似た働きをする。
このアナモレリンを用いた海外での第3相臨床試験は、すでに終了し、成績が報告されている。
それによると、対象は切除不能の非小細胞肺がん患者で、悪液質の症状を持つ174例。これをプラセボ群とアナモレリン投与群に割り付けて試験をした。その結果、アナモレリン群ではLBM(骨格筋指数:骨格筋量の指標)と体重が増加し、食欲の亢進が認められた。
アナモレリンを用いた同様のトライアル(臨床試験)は国内でも実施されている。こちらは、消化器がんを対象としたオープン試験だが、アナモレリンを投与したほとんどの患者で骨格筋量が増え、食欲も改善した。
こうしたデータを踏まえて、2018年に国内製造販売の承認申請が行われた。多くの関係者は「認可されるだろう」と予測したが、厚生労働省の審査では、有効性評価の指標がよくわからないなどの理由で継続審議となっている。
光永さんによると、これまでがん悪液質患者の食欲を亢進する薬剤はなかった。そうした中で、アナモレリンは食欲不振と体重減少を有意に改善した。これは、非常にインパクトのある結果だという。
「ただ問題は、骨格筋量や体重が増えたにもかかわらず、6分間歩行など身体機能の改善が得られなかったこと。骨格筋量や体重の増加が、臨床的にどのような意義、メリットを持つのか、サブ解析などによってその点を証明していくのが今後の課題です」(光永さん)
がん悪液質の治療では、栄養療法や運動療法も選択肢に挙げられている。すでに海外ではいくつかの臨床試験が組まれているが、芳しい成績は得られていない。
その中で注目されている国内の取組みがある。日本がんサポーティブケア学会悪液質部会が中心となり進めている「NEXTAC-TWO」という無作為化試験だ。未治療の進行非小細胞肺がん、進行膵がん患者130例を、対照群と治療群に割り付け、治療群には通常の化学療法に、栄養療法、運動療法などによる多モード介入を行うもので、現在、進行中。2年後には成績は報告される見込みだ。
光永さんは「NEXTAC-TWOはがん悪液質を対象とした試験ではないが、患者の中には悪液質の人がかなり含まれている。そうした人たちに対して、運動療法や栄養療法による介入が、どの程度の効果を持つのか。サポーティブケア(支持医療)の1つとして、期待をもって結果を待ちたい」と話している。取材・文●「がんサポート」編集部
がんと栄養相談窓口
がん患者さん、そのご家族のためのがんと栄養の相談窓口です。気軽にご相談ください。
- どんなレシピがあるのか知りたい
- 必要な栄養って何?
- カロリーはどのくらい?・・・など


