検査・診断
骨髄異形症候群の類縁疾患、診断、リスク分類、治療選択など検査や診断に関してご紹介します。
骨髄異形症候群の検査
骨髄異形症候群の診断と治療方針は、血液検査、骨髄検査、染色体検査などの結果から決められます。「自覚症状がなく、健康診断などの血液検査で血球数などに異常が認められた人」や、「貧血、倦怠感、息切れなどの症状があり血液検査を受けた結果、骨髄異形症候群の疑いありとされた人」などは、骨髄検査を受けます。
血液検査
採血した血液で、白血球、赤血球、血小板の数や血液細胞の形態異常、芽球(がきゅう:幼若な形態の血液細胞)の有無を調べます。
骨髄検査
骨髄検査のためには、まず骨髄の採取が行われます。骨髄血の採取は「骨髄穿刺(せんし)」、骨髄組織の採取は「骨髄生検」という方法で行われます。骨髄穿刺は、皮膚に近く浅いところにある腰骨(骨盤)や胸骨に、骨髄穿刺用の針を刺し注射器で骨の中にある骨髄血を吸い出します。局所麻酔をしますが、骨髄を吸い出すときには痛みがあります。骨髄生検は、腰骨にやや太い針を刺し、骨髄組織を採取します。
採取した骨髄血や骨髄組織は、顕微鏡による観察で、細胞数や種類、形態の異常、芽球割合を調べます。
染色体検査
「Gバンド法」という方法で、骨髄細胞中に染色体異常がないかを調べます。
フローサイトメトリー検査
フローサイトメトリー検査は、専用の検査機器を用いて細胞の特性などに応じたレーザーの反応を、数値化・グラフ化する検査です。骨髄異形症候群のフローサイトメトリー検査では、CD34という分子を発現している細胞の数や骨髄液に含まれる割合などを調べます。
骨髄異形症候群の類縁疾患
骨髄異形症候群には、骨髄増殖性腫瘍、急性骨髄性白血病、再生不良性貧血など、類縁疾患が多く、相互移行することがあります。異形成があっても芽球(がきゅう:幼若な形態の血液細胞)の割合が高ければ、急性骨髄性白血病と診断されます。また、骨髄増殖性腫瘍は、無効造血や異形成があまり認められないため骨髄異形症候群とは区別されますが、どちらも造血幹細胞のクローン性異常に基づくと考えられています。国際的な分類である「WHO分類第4版(2017年改定)」では、まとめて、骨髄異形症候群/骨髄増殖性腫瘍とし、同じ疾患に分類されています。
骨髄異形症候群と類縁疾患
| 血球減少 | 形態学的異形成 | 芽球比率 | |
|---|---|---|---|
| 骨髄異形症候群 | 減少 | あり | 20%未満 |
| 骨髄異形症候群/ 骨髄増殖性腫瘍 | さまざま 白血球は通常増加 | あり | 20%未満 |
| 骨髄増殖性腫瘍 | 一系統以上で増加 | なし | 20%未満 |
| 急性骨髄性白血病 | 白血球はさまざま 貧血・血小板減少あり | ときにあり | 20%以上 |
| 再生不良性貧血 | 減少 | ときにあり | 5%未満 |
出典:不応性貧血(骨髄異形症候群)診療の参照ガイド(平成22年度改訂版)
骨髄異形症候群の診断
骨髄異形症候群の診断は、WHO分類第4版(2017年改定)に基づき、血球減少、末梢血と骨髄の芽球(がきゅう:幼若な形態の血液細胞)の異形成、染色体異常の検査値を元に行われます。また、類縁疾患が多いため他疾患との鑑別が行われます。診断の確定後は、血液、骨髄、染色体異常などの所見から予後予測が行われ、治療選択が決定されます。
WHO分類第4版(2017年改定)による「骨髄異形症候群」の病型分類
| 単一血球系統の異形成を伴う骨髄異形成症候群 |
|---|
| 環状鉄芽球を含む骨髄異形成症候群 |
| 環状鉄芽球および単一血球系統の異形成 |
| 環状鉄芽球および多血球系統の異形成 |
| 多血球系統の異形成を伴う骨髄異形成症候群 |
| 芽球の増加を伴う骨髄異形成症候群 |
| 染色体5q欠失を伴う骨髄異形症候群 |
| 分類不能な骨髄異形症候群 |
| 暫定的病型:小児不応性血球減少症 |
出典:Swerdlow SH, et al(Editors). WHO classification of tumours of haematopoietic and lymphoid tissues. Lyon: IARC Press;2017より和訳
骨髄異形症候群のリスク分類
骨髄異形症候群は、病型分類だけでは十分な予後予測は困難と考えられているため、IPASSと呼ばれる予後予測法によりリスク分類が行われます。IPASSは、骨髄異形症候群の所見でみられる「骨髄芽球割合」「血球減少系統数」「染色体グループ」をスコア化し、合計点数により4つのグループに分類するものです。
IPASSを改訂したIPASS-Rは、IPASSと同じ因子が使われますが、「染色体核型の分類」と「芽球割合や血球減少の取り扱い」が変更され、5つのグループに分類することで予後予測の精度が向上しています。そのため、最近はIPASS-Rによるリスク分類がよく使われるようになってきています。
IPSS-R 予後因子スコア
| 予後因子の配点 | 0 | 0.5 | 1 | 1.5 | 2 | 3 | 4 |
|---|---|---|---|---|---|---|---|
| 核型 (染色体リスク群参照) | とても良い | - | 良い | - | 中程度 | 悪い | とても悪い |
| 骨髄芽球比率 (%) | ≦2 | - | >2~<5 | - | >10 | >10 | - |
| 赤血球数 (g/dL) | ≧10 | - | 8~<10 | <8 | - | - | - |
| 血小板数 (×103/μL) | ≧100 | 50~<100 | <50 | - | - | - | - |
| 好中球数 (×103/μL) | ≧0.8 | <0.8 | - | - | - | - | - |
出典:一般社団法人日本血液学会編. 造血器腫瘍診療ガイドライン 2023年版.金原出版 第I章 白血病、I 白血病、6骨髄異形症候群 表3より作成
IPSS-Rにおける染色体リスク群
| 予後グループ | 染色体核型 |
|---|---|
| とても良い | Y染色体喪失、11q欠失 |
| 良い | 正常,5q欠失,12p欠失,20q欠失,5q欠失を含む2つの異常 |
| 中程度 | 7q欠失,8番染色体増加,19番染色体増加,17q同腕染色体,その他の1つまたは2つの異常 |
| 悪い | 7番染色体喪失 3番染色体逆位/3q転座/3q欠失 7番染色体喪失/7q欠失を含む2つの異常 複雑核型:3個 |
| とても悪い | 複雑核型:3個より多いもの |
出典:一般社団法人日本血液学会編. 造血器腫瘍診療ガイドライン 2023年版.金原出版 第I章 白血病、I 白血病、6骨髄異形症候群 表4より作成
IPSS-Rによる予後層別化
| リスク群 | 点数 |
|---|---|
| とても低い | ≦1.5 |
| 低い | >1.5~3 |
| 中程度 | >3~4.5 |
| 高い | >4.5~6 |
| とても高い | >6 |
出典:一般社団法人日本血液学会編. ”造血器腫瘍診療ガイドライン 2018年版”.金原出版,2018. 第I章 白血病、I 白血病、6骨髄異形症候群 表5より作成
骨髄異形症候群の治療選択
骨髄異形症候群に対する治療では、「定期的な経過観察」「社会生活を含む患者活動への支援」「血球減少への対応」「感染症への対応」など基本的な支持療法が行われ、リスク分類により治療選択が行われます。リスク分類は、IPASS-Rが最も広く利用さており、IPASS-Rのリスク分類では、「とても低い」と「低い」が低リスクに分類され、「高い」と「とても高い」が高リスクに分類されます。
低リスクでは、血球減少に対する症状改善が第一目標です。低リスクと判定された場合で、症状がなければ経過観察となります。症状があれば、症状に合わせた治療が行われます。血球減少に対する治療は、「輸血療法」「免疫抑制療法」「サイトカイン療法」「タンパク同化ステロイド療法」「ビタミン製剤」「レナリドミド」「アザシチジン」による治療から選択されます。
輸血療法により、鉄過剰症となった場合は、鉄キレート療法が行われます。また、サイトカイン療法や免疫抑制療法の対象とならない患者さんに対しては、アザシチジン投与で血球減少の回復は認められますが、生存期間の延長を目的とした第一選択薬としては推奨されていません。「5番染色体長腕の欠損(5q-)を伴う5q-症候群」による血球減少に対してはレナリドミドが選択されます。
高リスクと判定された場合は、積極的な治療が検討されます。白血病への転化リスクが高ければ、より積極的な治療方針が検討されます。年齢や患者さんの病態、ドナーが得られるなど条件が整っていれば、同種造血幹細胞移植が行われます。ドナーはできる限り、HLA型の不適合が1座以内の血縁者が望ましいとされていますが、血縁者に適合者がいなければ、HLA型が一致した非血縁者も検討されます。また、骨髄・末梢血幹細胞ドナーが得られない高リスク患者さんでは、臍帯血移植も検討されます。同種造血幹細胞移植では、大量の細胞傷害性抗がん剤や全身放射線照射による強力な前処置が行われます。強力な前処置がリスクとなる高齢の患者さんや合併症をもつ患者さんでは、減弱した前処置による同種造血幹細胞移植も治療選択肢として検討されます。
同種造血幹細胞移植が行えない患者さんに対する第一選択薬は、アザシチジンです。また、ドナーを待つ患者さんでは、ドナーが見つかるまでの「つなぎ治療」としても、アザシチジンによる治療が検討されます。5q-でアザシチジン不応または不耐の場合は、レナリドミドによる治療が検討されます。
同種造血幹細胞移植が困難で、染色体異常、全身状態、罹病期間などの予後不良因子のない若年患者さんで、アザシチジンが使用できない場合は、強力化学療法も治療選択の一つとなります。強力化学療法と低用量化学療法では、生存期間はほぼ同等なため、どちらを選択するかは患者さんごとに判断されます。
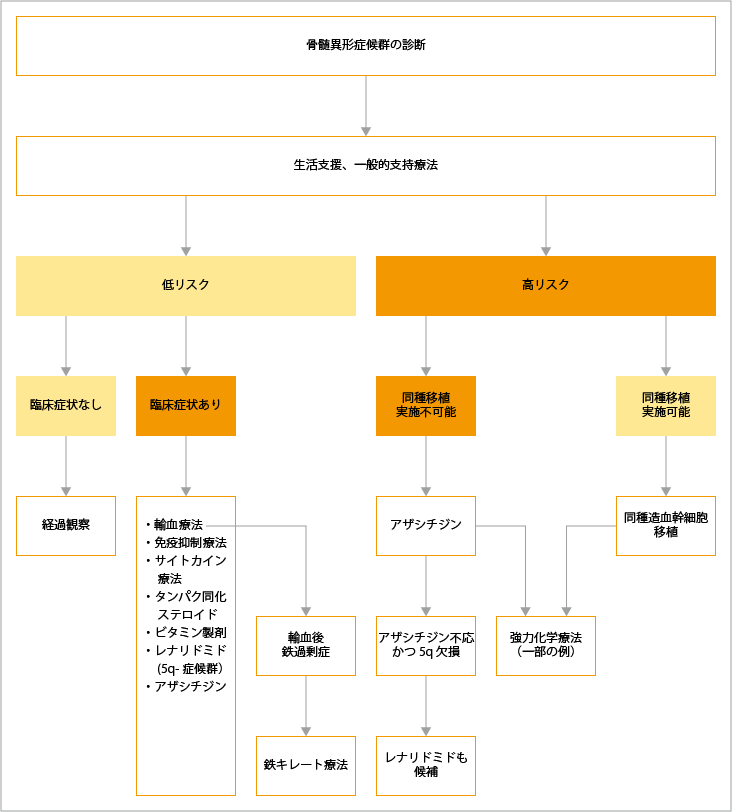 出典:一般社団法人日本血液学会編. 造血器腫瘍診療ガイドライン 2023年版.金原出版 第I章 白血病、6骨髄系症候群アルゴリズムより作成
出典:一般社団法人日本血液学会編. 造血器腫瘍診療ガイドライン 2023年版.金原出版 第I章 白血病、6骨髄系症候群アルゴリズムより作成参考文献:一般社団法人日本血液学会編. 造血器腫瘍診療ガイドライン 2023年版.金原出版

