慢性骨髄性白血病(CML) 早期に寛解導入で治癒を目指す最新治療

2018.9 取材・文:町口充
血液がんの治療に関する最新情報は、「血液がんを知る」をご参照ください。
かつて慢性骨髄性白血病(CML)は、造血幹細胞移植をしなければ治癒は望めない病気といわれていましたが、原因となる遺伝子をターゲットにした分子標的薬(チロシンキナーゼ阻害薬:TKI)が2001年に登場すると、治療は一変しました。今では第二世代、第三世代の薬も開発され、早期に病気を抑えれば、服用を続けながら通常の生活を送れるようになり、同時に、深い寛解を得て、薬の服用をやめることを目指した治療を行う時代になっています。
慢性骨髄性白血病とは
白血病は、血液細胞のがんです。血液中にある赤血球、血小板、白血球の血液細胞をつくる細胞が骨髄でがん化し、がん化した細胞が骨髄内で増殖して占拠してしまうため、正常な血液細胞が減少し、感染症にかかりやすくなったり、貧血になったり、出血しやすくなったりなどさまざまな症状が起こります。
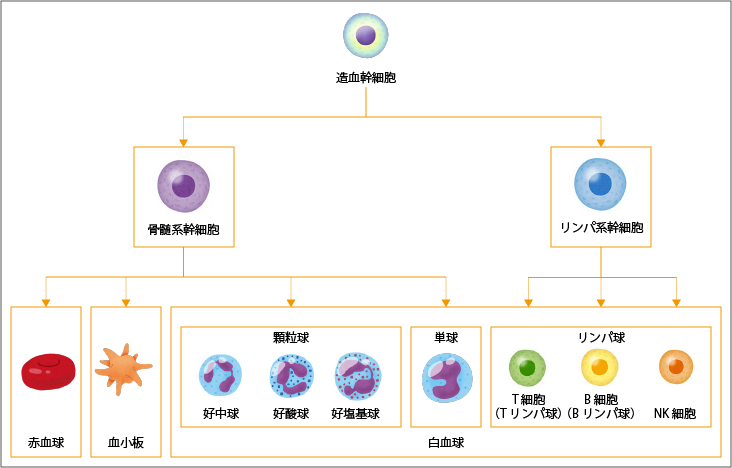
骨髄の中にある造血幹細胞は、赤血球、白血球、血小板などのすべての血液細胞のもとになる細胞として、自己複製しながら、一方でさまざまな血液細胞へ分化していきます(図1参照)。造血幹細胞は、骨髄系の細胞とリンパ系の細胞に分化します。そして、赤血球、血小板、および、白血球のうち顆粒球(好中球、好酸球、好塩基球)と単球へ分化します。リンパ系細胞は、白血球のうちT細胞(Tリンパ球)、B細胞(Bリンパ球)、NK細胞というリンパ球へと、成熟・分化して、血液の中に出ていきます。
白血病は、骨髄性やリンパ性、あるいは急性と慢性といった分類があります(表1参照)。血液の元となる細胞のうち、骨髄系細胞ががん化したものを骨髄性白血病、リンパ系細胞ががん化したものをリンパ性白血病といいます。骨髄の中で急速にがん細胞が増加して貧血や血小板減少、あるいは白血球の増加や減少をもたらし、発熱や貧血、出血傾向などの急性の症状が出現する急性の白血病と、そうした急性症状を呈しない慢性の白血病があります。
表1 白血病の主な分類
| 骨髄性 | リンパ性 | |
| 急性 | 急性骨髄性白血病 (AML: acute myeloid leukemia) | 急性リンパ性白血病 (ALL: acute lymphoblastic leukemia) |
| 慢性 | 慢性骨髄性白血病 (CML: chronic myelogenous leukemia) | 慢性リンパ性白血病 (CLL: chronic lymphocytic leukemia) |
慢性骨髄性白血病(以下、CML)は、骨髄系の細胞ががん化したタイプで、未熟なものから成熟した細胞まですべてが骨髄の中で増加します。
発症率は、日本においては人口10万人あたり1人程度です。中年以降の発症数が多く、発症年齢中央値は53歳であるため、高齢化の進展とともに患者数は増加傾向にあります。男女別では男性にやや多いと報告されています。
原因となる遺伝子が特定されていないがんが多い中で、CMLは発生原因となる遺伝子が突き止められています。
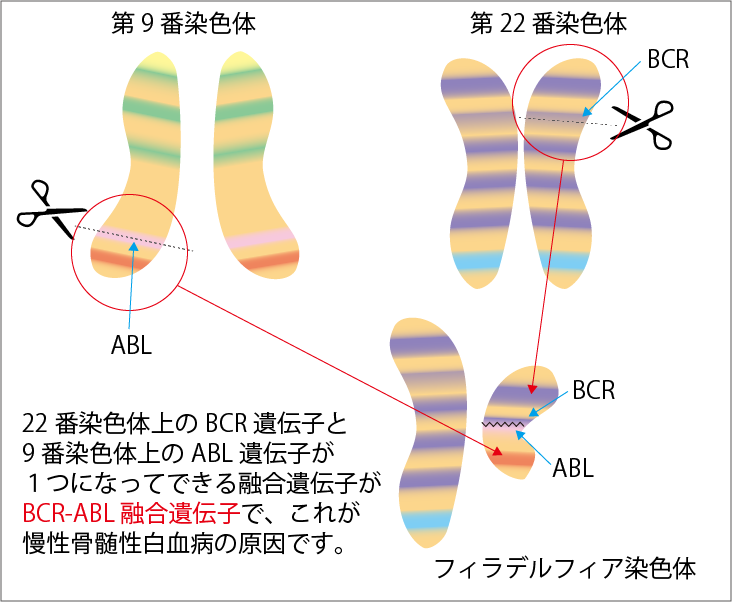
人間には46本の染色体がありますが、CMLの患者さんではこのうち9番と22番の染色体が一部入れ替わってつながった短い染色体が生じていることがわかっています(図2参照)。この染色体はフィラデルフィア染色体と呼ばれます。染色体が入れ替わってつながるとき、もともと22番染色体の上にあるBCR遺伝子と、9番染色体上にあるABL遺伝子が新たに結合してBCR-ABL遺伝子ができます。これが、CMLの原因遺伝子です。このBCR-ABL遺伝子は、細胞の中にBcr-Ablタンパクをつくります。このタンパクには特有のポケットがあり、ATPというエネルギー物質がポケットにつくとスイッチが入ってBcr-Ablタンパクが活性化します。Bcr-Ablタンパクは「白血病細胞を増やせ」という指令を出し、白血病細胞が無限に増えていくと考えられています。ただし、フィラデルフィア染色体がつくられる原因は不明です。
慢性骨髄性白血病の症状、検査、診断
CMLの病状の特徴として、慢性期、移行期、急性期の3段階に分かれていることが知られています。慢性期では進行が遅く、また、増えてくる白血病細胞はこの時点では正常な血球とほぼ同じ機能を有しているため、自覚症状はほとんどありません。移行期になると成熟する能力を失った芽球が増え、白血球もさらに増えてくるので、貧血や全身のだるさ、発熱、脾臓の腫れでおなかが張ってくるといった症状が見られるようになります。急性期になると急性白血病と同じような症状があらわれるようになり、強い貧血や出血傾向、高熱などが出現します。
CMLの85%は、慢性期で発見されています。企業健診や市区町村による健診などで血液検査を受けた際に白血球数の高値がわかるなどがきっかけとなり、この時点では半数の人が無症状です。白血球数はときに基準上限値の10倍以上になります。特に、好中球系の若い段階の幼弱な血球細胞が血中にあらわれることと好塩基球の増加がCMLのきわめて特徴的な所見です。
血液検査でCMLが疑われたら骨髄検査を行います。腰にある腸骨から骨髄液を採取して調べます。骨髄中の細胞の数や種類を調べるとともに、染色体や遺伝子の検査もあわせて行い、フィラデルフィア染色体およびBCR‐ABL遺伝子の有無を確認することにより最終的な確定診断となります。
慢性骨髄性白血病の治療
BCR-ABL遺伝子の働きを抑え込む分子標的薬(チロシンキナーゼ阻害薬:TKI)のイマチニブ(製品名:グリベック)が、2001年に登場しました。これによりCMLの治療成績が一気に向上しました。イマチニブは、BCR-ABL遺伝子によってつくられるBcr-Ablタンパクをターゲットにし、Bcr-Ablタンパクが活性化するスイッチをオフにする薬です。
イマチニブとそれまでの標準治療であるインターフェロン+シタラビン(製品名:キロサイド)の併用療法とを比較した臨床試験の結果で、イマチニブの圧倒的な治療効果が示されました。
この結果、生存期間の大幅な延長が可能となり、2000年ぐらいまでは“予後不良疾患”とされ、生存期間の中央値(治療を受けた集団の中でちょうど真ん中の人が生存した期間)が3~6年でしたが、イマチニブが登場した2001年以降は“予後良好疾患”に変わりました。
従来の治療では、ドナーから提供された造血幹細胞を移植する同種造血幹細胞移植が、治癒が得られる唯一の治療法とされていました。しかし、これによって60~70%の患者さんで長期生存・治癒が期待できる一方で、移植後の特有の合併症などが生活の質を低下させることなどが問題でした。これに対して、初回治療時でイマチニブの治療を受けた患者さんでは長期生存率が90%以上に達し、そのうちCMLが原因で亡くなった人はわずか5%に留まっていて、同種造血幹細胞移植を含む従来の治療法を大きく上回る成績であることから、現在ではCMLに対する治療の第1選択薬は分子標的薬と位置づけられています。
さらに、イマチニブに続いて、第二世代のTKIであるニロチニブ(製品名:タシグナ)、ダサチニブ(製品名:スプリセル)、第三世代のボスチニブ(製品名:ボシュリフ)、ポナチニブ(製品名:アイクルシグ)も登場しました。治療の選択肢が広がっており、今では生存期間の中央値は25年以上といわれています。
慢性骨髄性白血病の治療効果の判定基準
CMLでは次のような治療効果の判定基準があり、これをどこまでクリアできたかが重要となります。
治療を始めて最初にクリアすべき基準は「血液学的完全寛解(CHR)」です。治療開始後、2週間に1回程度血液を採取して調べ、白血球数が1万未満、血小板数が45万未満、白血球数の内訳で幼弱な細胞がなく好塩基球が5%未満で、脾臓の腫れが見られなくなった状態です。
次に3~6か月に1回程度、染色体検査を行い、フィラデルフィア染色体をもつ細胞が見つからなくなったら「細胞遺伝学的完全寛解(CCyR)」と判断します。
その後は、血液中の細胞のBCR-ABL遺伝子量を調べて、0.1%以下になると「分子遺伝学的効果(MMR)」と判断します。この検査で2回連続してBCR-ABL遺伝子がさらに低下して0.0032以下の場合、「分子遺伝学的完全寛解(DMR)」到達と判断されます。
慢性骨髄性白血病の新たな治療戦略
日本でイマチニブが使われるようになってから20年近くがたちました。依然として初回治療の第1選択薬はイマチニブなのかというと、これには議論があります。
たしかに基本的には第1選択の薬はイマチニブです。なぜなら、イマチニブは20年近い使用経験があり、長期の安全性が確かめられているうえに副作用に対する管理のノウハウが確立しています。加えて第二世代以降の薬剤に比し安価であることもあげられます。
一方で、CMLが治る時代となり、治るということは薬の使用をやめても再発しない可能性のある時代になってきました。そこで出てきた考え方が、第一世代の薬であるイマチニブを使うより、より早く深い奏効が得られる第二世代の薬を初回治療のときから使ったほうが、早い段階でより深い効果が達成され、結果的に薬からも解放されやすくなるというものです。
遠泳を例に説明します。患者のAさん、Bさん、Cさんがプールで同じスタートラインに立ち、同じ距離を泳ぎきってゴールすればBCR-ABL遺伝子量が0.1%以下になるMMR(分子遺伝学的効果)を達成できるとします。Aさんは6か月で泳ぎきってMMRを達成しました。一方、Bさんはその倍の1年かけて泳ぎきり、Cさんは3倍の1年半かけてゴールに達しました。
「泳ぐ期間は短くても長くてもMMRを達成できる距離を泳ぎきればよいのではないか」と思いたいところですが、もしもこのプールにはサメが潜んでいたら話は変わります。長く泳いでいたら、それだけサメに襲われる危険性が増してしまいます。
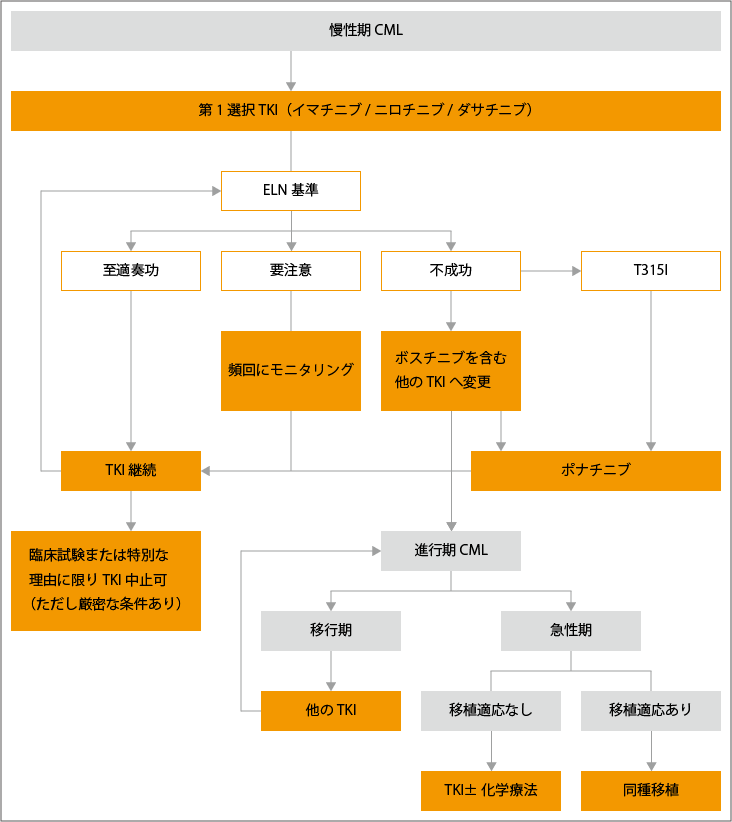
このため、現在は、初期治療を開始した数か月間の早い段階での治療効果(EMR:早期分子遺伝学的効果)をみて、薬剤の変更を検討するという方針がとられています。具体的には、イマチニブによる治療開始から3か月の時点でBCR-ABL遺伝子が10%以下、6か月の時点では1%以下になるというEMRを達成し、なおかつ副作用に対処して内服できていれば、そのままイマチニブを継続します。一方、EMRを達成できていない場合は、早い段階で薬をやめることを前提にしているならば、第二世代のニロチニブ、またはダサチニブに変更します。
イマチニブとニロチニブ、ダサチニブで比べると、薬の効果はグリベックを1とするとニロチニブで20倍、ダサチニブで325倍と大きな差があります。このため、特に年齢の若い患者さんの場合は第二世代の薬を積極的に使うことを考慮してもよいでしょう。
もう1つの理由は、TKIによる治療を行っている間は男性・女性を問わず避妊が必要なことです。将来、お子さんをつくる希望がある場合は、TKIを短期間で終わらせたいと思うのは当然のことでしょう。ある20代の男性の例ですが、ダサチニブによる治療の結果、DMRに到達して薬をやめて、大学生だった彼はその後就職して結婚。お子さんが生まれて幸せな家庭生活を送っています。
イマチニブのストップ試験
CMRが得られたあとにTKIによる治療を中止することに関しては、すでに国内外での検討が行われています。
2010年にフランスで行われた STIM試験(ストップ・イマチニブ・スタディ)では、「イマチニブ投与でCMRを達成したあとに投薬を中止したところ、2年後でも約40%がCMRを維持していた」との結果が明らかになりました。これまでは治療を中断すれば再発すると考えられ、「分子標的薬は治療効果が認められるかぎりは継続する」というのが治療の原則となっていました。同様の研究はオーストラリアでも行われていて、フランスの場合と同等の42%がCMRを維持していたとの報告があります。
当院でのCMLに対するTKI中止症例16例についての検討では、50%の患者さんが中止後、再発もなく経過しています。また中止後に再発した症例でも、TKIの投与を再開すると以前と同様の効果があらわれています。
慢性骨髄性白血病の薬の選択と副作用
薬剤選択にあたっては副作用の問題も見逃せません。各TKIそれぞれで副作用は異なっています(表2参照)。このため、脳梗塞や血栓症、高血圧症など、ほかの病気を併せもつ患者さんに対しては、合併症を考慮して薬を使い分ける必要がありますが、TKIの中で最も副作用が穏やかなのがイマチニブです。
定期的に行われる治療効果の判定から薬の効果が鈍っていることがわかった場合は、遺伝子変異の検査を行い、治療薬を変更します。現在は、どのような遺伝子変異が起こると、どのTKIが効かなくなるか、さらに、次の治療にはどのTKIを選択すべきかが明らかになっているので、適切な薬剤選択が可能となっています(表3参照)。
表2 TKIと副作用
| 薬剤名(製品名) | 主な副作用 |
|---|---|
| イマチニブ(グリベック) | 浮腫、筋肉痛、悪心 |
| ニロチニブ(タシグナ) | 心電図異常・QT延長、膵炎、高血糖、肝障害、血管有害事象、末梢動脈閉塞 |
| ダサチニブ(スプリセル) | 胸水、骨髄抑制、肺高血圧、出血 |
| ボスチニブ(ボリュリフ) | 下痢、肝障害、高血圧 |
| ポナチニブ(アイクルシグ) | 血管有害事象、膵炎、肝障害、骨髄抑制、高血圧 |
表3 遺伝子変異と選択すべきTKI
| 遺伝子変異 | 抵抗性を示すTKI | 選択すべきTKI |
|---|---|---|
| T315I | ニロチニブ、ダサチニブ、ボスチニブ | ポナチニブ |
| T315A、F317L/I/C | ダサチニブ | ニロチニブ、ボスチニブ |
| Y253H、F359V/C/I | ニロチニブ | ダサチニブ、ボスチニブ |
| V299L | ダサチニブ、ボスチニブ | ニロチニブ |
| E255K/V | ニロチニブ、ボスチニブ | スプリセル |
慢性骨髄性白血病の造血幹細胞移植
また、TKIのいずれもが効かなくなった患者さんや、副作用が重くてTKIを使い続けることができない場合、あるいは診断時にすでに移行期や急性期である患者さんに対しては、造血幹細胞移植が検討されることがあります。移植する場合、白血球適合抗原(HLA)が完全一致、あるいは一抗原不一致のドナーを選ぶのが一般的ですが、適切なドナーがみつからないこともしばしばあります。特にHLAが一致した兄弟姉妹からの「同胞間移植」では、少子化に伴い同胞ドナーが得られないケースも増えています。そこで最近は、HLAが半分だけ一致しているHLA半合致ドナーからの移植が試みられるようになっています。
ただし、HLA半合致移植は、血縁や骨髄バンク、臍帯血バンクでもドナーが見つからず、それでも移植の必要性が高い場合に行われるもので、慎重さが求められるのはいうまでもありません。
造血器腫瘍診療ガイドライン2018年版を参考に作成
プロフィール
大橋一輝(おおはし・かずてる)
1997年 がん・感染症センター都立駒込病院 血液内科医員
2012年 がん・感染症センター都立駒込病院 血液内科部長

