治療と副作用
肺がんの手術
非小細胞肺がんは、ステージ1~2と、3Aの一部が手術の対象となります。小細胞肺がんは、限局型のステージ1が手術の対象です。手術可能なら、肺がんを根治するためには、がんを切除する手術が最も推奨される方法です。
開胸手術
背中から脇にかけて胸部の皮膚を15cm~20cm程度切開し、肋骨を開いて行う手術です。
胸腔鏡下手術
胸部を数か所2cm程度切開し、胸腔鏡という内視鏡と手術機器を挿入して行われる手術です。胸腔鏡の先端には小型のカメラが装着されており、カメラで映し出されたモニターを使って手術は行われます。胸腔鏡下手術には、2つの方法があります。開胸手術ほど大きくは切開せず、小さく開いた切開部から直接胸の中を見ながら、補助的に胸腔鏡を使用する「胸腔鏡補助下手術」と、大きな開胸を伴わず、内視鏡で映し出したモニター画面を見ながら行われる「完全胸腔鏡下手術」です。
胸腔鏡下手術のメリットは、開胸手術に比べて傷が小さく術後の痛みが少なくてすむことです。デメリットは、とっさの対応が遅れて途中から開胸手術へ変更される場合があることです。また完全胸腔鏡下手術では、カメラで映し出されたモニターを見ながら手術機器の操作が行われるため、新しい手技の習練と手術器具が必要です。そのため、限られた施設でのみ行われています。
肺がんの肺葉切除+リンパ節郭清
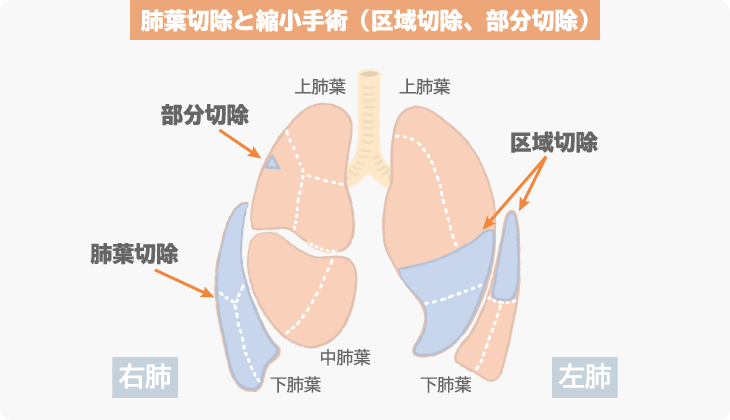
肺は、気管支が左右に分かれた先に2つあります。右側が上葉、中葉、下葉の3つに分かれ、左側は上葉と下葉の2つに分かれています。肺がんの標準的な手術では、この5つに分かれた肺葉ごとの切除とリンパ節の切除(リンパ節郭清)が行われます。がんがある肺葉ごと切除されますが、ほかの肺葉が呼吸機能を補うため、大きな支障がなく、目に見えないがん細胞の取り残しが防げるメリットもあります。
リンパ節郭清は、肺葉ごとに転移しやすいリンパ節がある程度予測できるようになってきたため、転移しやすいリンパ節のみを郭清するようになってきています。
呼吸機能をなるべく温存するために、小さいがんに対しては、肺葉よりさらに小さい切除を行う縮小手術という方法も行われる場合があります。肺は、5つの肺葉をより詳細に分けると、右側の肺では10の区域、左側の肺では8の区域に分けられます。この区域単位で切除するのが縮小手術です。さらに、がんがある部分のみを楔形にくりぬくように切除する部分切除という手術もあります。縮小手術は、切除範囲が小さいため、体への負担も少なく、肺葉切除に比べると呼吸機能を温存できる一方で、腫瘍径が3cm以下の非小細胞肺がんを対象とした臨床試験では、根治性が落ちたという結果もあります。そのため、現在は、肺葉切除が標準的な手術方法となっています。
肺がんの手術の副作用
通常、肺がんの手術では、がんがある肺葉ごとに切除されますが、がんが複数個あったり、肺葉をまたがっていたりする場合などには、片側の肺全体を摘出することもあります。片肺の全摘は、根治を目指す治療としては、効果が高く期待できる治療ですが、手術による痛みや痰の増加、呼吸機能の低下による息切れなど副作用も起こります。
肺がんの手術後は、さまざまな合併症が起こる可能性もあるため、それぞれの症状に合わせた対策がとられます。主な合併症とその対策は、以下の通りです。
肺炎
肺がんの手術後の合併症の1つが肺炎です。特に喫煙者に多くみられます。手術による呼吸機能の低下や痛みにより、痰を吐き出しづらくなることに加え、手術の影響で免疫が低下していることもあり、肺炎になりやすいと考えられています。肺炎にならないための予防措置として、喫煙者は禁煙、口腔ケア、手術前から腹式呼吸など運動を行うなど、手術前の準備も大切です。
肺瘻(はいろう)
肺がんの手術では、肺の正常な部分も切開するため、手術後に切開した部分から空気が漏れる肺瘻という合併症が起こることがあります。大きく息を吸って肺が膨らんだ時や、咳をするなど圧力がかかったときに、空気が漏れ出すことがありますが、通常は自然にふさがります。空気の漏れが自然に止まらない場合は、胸膜を癒着させる薬が使われますが、それでも漏れが止まらない場合は、再手術が必要になる場合もあります。空気が止まらず、肺瘻の状態を放置すると細菌感染を起こし胸膜炎になることもあるため、気になる症状があったら担当医に伝えましょう。
気管支断端瘻(きかんしだんたんろう)
肺がんの手術の際には、気管支も切断しますが、切断した気管支は空気が漏れないように縫合されます。まれに縫合したところに穴が開き、空気や痰が漏れてしまうことがあります。これが気管支断端瘻とよばれる合併症です。空気や痰が漏れると細菌感染を起こしやすくなり、感染が起こると膿がたまり、その膿を吸い込むことが原因で肺炎になることもあるため、空いた穴をふさぐ手術が必要になります。
声のかすれ(嗄声:させい)
肺がんの標準的な手術では、肺葉切除とともに近くのリンパ節の切除も行われます。このリンパ節の近くには、反回神経という声帯を動かす神経がありますが、リンパ節切除がこの反回神経に影響を及ぼし、まひを起こす可能性があります。反回神経がまひすると、声のかすれや、嚥下障害が起こり、むせたり肺炎の原因になったりすることもあります。3~6か月程度で自然に治ることもありますが、自然回復しない場合は、治療が必要になります。
肺、脳、心筋梗塞
肺がんの手術に限りませんが、長時間体を動かさないことで血行が悪くなり、血栓(血のかたまり)ができやすくなります。エコノミー症候群のように、血管の中にできた血栓が血液の流れにのり、肺、脳、心臓などの重要な血管を詰まらせることで、まれではありますが、肺梗塞、脳梗塞、心筋梗塞など後遺症や命にかかわる重大な合併症を起こす可能性があります。
特に、動脈硬化がある患者さんでは、リスクが高くなります。こうしたリスクの高い患者さんでは、血を固まりにくくする薬の使用や、血栓ができやすい足のマッサージなどにより、予防対策が行われます。
肺がんの放射線治療
放射線治療は、根治を目指す「根治的放射線治療」と、転移が原因で起こる症状を緩和する「緩和的放射線治療」の2つがあります。
非小細胞肺がんでは、ステージ1~2でも医学的な理由や高齢などの理由で手術ができない場合と、ステージ3で化学放射線療法ができない場合に放射線治療が行われます。
小細胞肺がんでは、限局型が放射線治療の対象となりますが、脳転移予防を目的として「予防的全脳照射」を行うこともあります。放射線治療は、どれだけ放射線を照射できたかで治療効果が異なります。従来の放射線照射機器では、がん細胞だけでなく周辺の正常な組織にまで影響があるため、1回の照射量を少なくし、何回かに分けて照射していました。現在は、がん細胞にピンポイントで放射線を照射できる機器も開発され、そうした機器を用いた場合、1回の照射量を増やし照射回数を少なくすることで、治療効果を高め副作用も少なくすることが可能になってきています。
体幹部定位放射線治療(SBRT)
3次元的に多方向から放射線を照射する治療です。がん細胞にピンポイントで照射できるため、通常の放射線治療より照射量を多くでき、治療効果が高いとされています。
定位放射線治療
小型の放射線装置が高精度のロボットアームに搭載されている放射線機器(サイバーナイフ)を使い、あらゆる方向から病変部に放射線のピンポイント照射を可能にした治療です。照射時の呼吸の動きに合わせて自動追尾する機能があるため、肺に対しても精密な放射線の照射が可能となっています。
肺がんの放射線療法の副作用
放射線治療は、がん細胞と周囲の正常な細胞との放射線感受性の差を利用した治療法です。手術による痛みがないなどの特徴はありますが、放射線治療特有の副作用があります。副作用は、放射線治療直後に起こる副作用と治療後しばらく時間が経ってから起こる副作用に分けられます。治療直後の副作用は皮膚炎、しばらく経ってから起こる副作用は、放射線肺炎、心膜炎、食道狭窄、肋骨骨折などです。
皮膚炎
放射線治療では、高エネルギーのX線などの放射線を照射するために、皮膚が炎症を起こして赤くなったり、乾燥して皮膚がむけたりする、いわゆる日焼けのような状態になる皮膚炎が起こります。炎症の程度により、痛みやかゆみといった症状が伴うこともありますが、炎症が強くなった場合は、治療を一時的に休止し、症状が治まるのを待ちます。症状は、一般的に数週間程度続きます。
食道炎
肺がんの放射線治療では、食道に近い胸の中央にあるリンパ節に放射線の照射を行うことがあり、その場合食道に炎症が起こることがあります。食事をしたときに喉がつかえる感じがしたり、胸がしみたり痛みを感じることもありますが、ほとんどが放射線治療後2~4週間で収まる一時的な症状です。症状がある間は、刺激の少ない柔らかい食事などを心掛けましょう。
放射性肺炎
放射線治療の1~2か月後くらいに、放射線を照射した肺の部分に炎症が起こり、発熱や息切れといった症状が出ます。多くの患者さんは、はっきりとした自覚症状がないまま数か月で症状が落ち着いていきます。広範囲に放射線治療を行った場合や肺にがん以外の疾患があった患者さんなどでは、放射線を照射していない範囲にも炎症が広がり、重症化することもあります。発熱や咳、息切れなどの自覚症状に注意しましょう。
心膜炎
肺と心臓は近くにあるため、放射線が心臓の一部に照射されると心臓を包んでいる心膜に炎症を起こすことがあります。心膜が炎症を起こすと心臓の周りに水がたまり、心臓の動きが悪くなり、息切れや動悸といった症状がでます。利尿剤などで改善することも多くありますが、重症であったり、緊急を要する場合などには、針を刺して水を抜く処置が行われる場合もあります。
肋骨骨折
肺がんの原発巣が肋骨に接していると肋骨にも高線量の放射線が照射されるため、肋骨骨折が起こります。治療後6か月~3年程度の期間で起こりますが、ほとんどの場合無痛で、多くの患者さんは気づきません。痛みがひどいときは鎮痛薬が使われることもあります。
肺がんの薬物療法
肺がんの薬物療法は、肺がんの種類、組織の違い、遺伝子変異、ステージ分類、全身状態などを総合的に判断して選択されます。薬物療法で使われる薬は、殺細胞性抗がん薬、分子標的薬、免疫チェックポイント阻害薬などです。
非小細胞肺がんでは、手術の前後で行う化学療法、手術ができない場合の化学療法、放射線治療と組み合わせて行われる化学療法があります。非小細胞肺がんは、扁平上皮がん、腺がん、大細胞がんの3つの組織型に分類され、組織型によって治療方針が異なり、腺がんと扁平上皮がんでは、使用できる薬や効果のある薬に違いがあります。
腺がんでは、患者さん個別の遺伝子変異を検査し、遺伝子変異に合わせた治療薬を使うプレシジョンメディシン(精密医療)が進んでいます。現在治療への有効性が判明しているのは、EGFR遺伝子、ALK融合遺伝子、ROS1融合遺伝子、BRAF遺伝子、MET遺伝子、RET融合遺伝子、KRAS遺伝子、NTRK融合遺伝子、HER2遺伝子の変異です。
小細胞肺がんは、抗がん剤の感受性が高いため、化学療法(薬物療法)の有効性が高いという特徴があります。
細胞障害性抗がん薬
がん細胞のDNAなどに作用することで分裂を阻害し、がん細胞の増殖を抑える薬です。現在、肺がんで使われる主な抗がん剤は、プラチナ系製剤や第3世代の抗がん剤です。
分子標的薬
がんの増殖に関わる分子を標的にした薬です。がん細胞に多く発現している特定の分子をターゲットにしているため、従来の抗がん剤より正常な細胞への影響が少なく副作用も少ないと考えられています。しかし、標的とした分子は、がん細胞だけに発現しているわけではないため、その分子が発現している部位に対しての影響はあり、副作用がないわけではありません。
免疫チェックポイント阻害薬
健康な人でもがん細胞はできているのですが、免疫細胞の攻撃により排除されています。免疫システムは、異物を攻撃する能力がある一方で攻撃を抑制する機能もあり、この攻撃と抑制のバランスを取りながら、健康を維持しています。ところが、がん細胞が変化して増殖していく過程で、免疫細胞の攻撃を抑え、細胞死から逃れるような能力を獲得する場合があります。この仕組みを免疫チェックポイント機構といいます。
免疫チェックポイント機構は、免疫細胞(T細胞)の表面に発現している物質とがん細胞が作り出した物質が結合することで、免疫細胞の攻撃にブレーキをかける仕組みです。これらの結合する物質を免疫チェックポイント分子といい、現在数種類の分子が見つかっています。
免疫の抑制は、免疫チェックポイント分子の結合により起こるため、分子同士を結合させないようにする薬が開発されており、これを免疫チェックポイント阻害薬といいます。現在、日本で肺がんに対して承認されているのは、T細胞に発現しているPD-1やCTLA-4と選択的に結合する抗体、および、がん細胞に発現しているPD-L1と選択的に結合する抗体です。
非小細胞肺がんのドライバー遺伝子に対する分子標的薬
| EGFR遺伝子変異陽性 | ゲフィチニブ | 250mg/日 | 1日1回 |
| エルロチニブ | 150mg/日 | 1日1回 | |
| アファチニブ | 40mg/日 | 1日1回 | |
| オシメルチニブ | 80mg/日 | 1日1回 | |
| ダコミチニブ | 45mg/日 | 1日1回 | |
| ALK融合遺伝子陽性 | クリゾチニブ | 500mg/日 | 1日2回 |
| アレクチニブ | 600mg/日 | 1日1回 | |
| セリチニブ | 450mg/日 | 1日1回 | |
| ロルラチニブ | 100mg/日 | 1日1回 | |
| ブリグチニブ | 90mg/日、day1-7 180mg/日、day8~ | 1日1回 | |
| ROS1融合遺伝子陽性 | クリゾチニブ | 500mg/日 | 1日2回 |
| エヌトレクチニブ | 600mg/日 | 1日1回 | |
| BRAF遺伝子V600E変異陽性 | ダブラフェニブ | 300mg/日 | 1日2回 |
| トラメチニブ | 2mg/日 | 1日1回 | |
| MET遺伝子変異陽性 | テポチニブ | 500mg/日 | 1日1回 |
| カプマチニブ | 800mg/日 | 1日2回 | |
| NTRK融合遺伝子陽性 | エヌトレクチニブ | 600mg/日 | 1日1回 |
| ラロトレクチニブ | 200mg/日 | 1日2回 | |
| RET融合遺伝子陽性 | セルペルカチニブ | 320mg/日 | 1日2回 |
| KRAS遺伝子G12C変異陽性 | ソトラシブ | 960mg/日 | 1日1回 |
| HER2遺伝子変異陽性 | トラスツズマブ デルクステカン | 5.4mg/kg、day1 | 3週間毎 |
出典:日本肺癌学会.肺癌診療ガイドライン―悪性胸膜中皮腫・胸腺腫瘍含む―2023年版.II.非小細胞肺癌(NSCLC).Ⅳ期非小細胞肺癌レジメンより作成
EGFR遺伝子変異陽性に対する併用レジメン
| ベバシズマブ併用 | エルロチニブ | 150mg/日 | 1日1回 |
| ベバシズマブ | 15mg/kg、day1 | 3週毎 | |
| ラムシルマブ併用 | エルロチニブ | 150mg/日 | 1日1回 |
| ラムシルマブ | 10mg/kg、day1 | 2週毎 | |
| 細胞傷害性抗がん薬併用 | ゲフィチニブ | 250mg/日 | 1日1回 |
| カルボプラチン | (AUC=5)、day1 | 3~4週毎 | |
| ペムブロリズマブ | 500mg/m2、day1 | 3~4週毎 | |
| ・4~6サイクル終了後、増悪を認めなければゲフィチニブ+ペムブロリズマブ併用の維持療法を考慮する | |||
出典:日本肺癌学会.肺癌診療ガイドライン―悪性胸膜中皮腫・胸腺腫瘍含む―2023年版.II.非小細胞肺癌(NSCLC).Ⅳ期非小細胞肺癌レジメンより作成
細胞傷害性抗癌薬+免疫チェックポイント阻害薬併用レジメン
| ペムブロリズマブ併用 | 非扁平上皮がんのみ シスプラチン75mg/m2、day1 もしくはカルボプラチンもしくは(AUC=5)、day1 ペメトレキセド*500mg/m2、day1 ペムブロリズマブ200mg/body、day1 ・4サイクル終了後、増悪を認めなければペメトレキセド+ペムブロリズマブ併用の維持療法を考慮する | 3週毎 |
| 扁平上皮がんのみ カルボプラチン(AUC=6)、day1 パクリタキセル200mg/m2、day1 もしくはナブパクリタキセルもしくは100mg/m2、day1、8、15 ペムブロリズマブ200mg/body、day1 ・4サイクル終了後、増悪を認めなければペムブロリズマブ単剤の維持療法を考慮する ・パクリタキセルを含むレジメンの場合、パクリタキセル投与30分前までにデキサメタゾン、H1、H2blockerの前投薬を行う | 3週毎 | |
| アテゾリズマブ併用 (非扁平上皮がんのみ) | カルボプラチン(AUC=6)、day1 パクリタキセル200mg/m2、day1 ベバシズマブ15mg/kg、day1 アテゾリズマブ1200mg/body、day1 ・4~6サイクル終了後、増悪を認めなければベバシズマブ+アテゾリズマブ併用の維持療法を考慮する ・パクリタキセル投与30分前までにデキサメタゾン、H1、H2blockerの前投薬を行う | 3週毎 |
| カルボプラチン(AUC=6)、day1 ナブパクリタキセル100mg/m2、day1、8、15 アテゾリズマブ1200mg/body、day1 ・4サイクル終了後、増悪を認めなければアテゾリズマブ単剤の維持療法を考慮する | 3週毎 | |
| ニボルマブ+イピリムマブ併用 | 非扁平上皮がんのみ シスプラチン75mg/m2、day1、22 もしくはカルボプラチンもしくは(AUC=5)、day1、22 ペメトレキセド*500mg/m2、day1、22 ニボルマブ360mg/body、day1、22 イピリムマブ1mg/kg、day1 ・2サイクル(6週間投与)終了後、増悪を認めなければニボルマブ+イピリムマブ併用の維持療法を考慮する | 6週毎 |
| 扁平上皮がんのみ カルボプラチン(AUC=6)、day1、22 パクリタキセル200mg/m2、day1、22 ニボルマブ360mg/body、day1、22 イピリムマブ1mg/kg、day1 ・2サイクル(6週間投与)終了後、増悪を認めなければニボルマブ+イピリムマブ併用の維持療法を考慮する | 6週毎 | |
| デュルバルマブ+トレメリムマブ併用 | シスプラチン(AUC=5または6)、day 1 ナブパクリタキセル100mg/m2、day 1、8、15 デュルバルマブ1500mg/body、day 1 トレメリムマブ75mg/body、day 1 ・4サイクル(12週間投与)終了後、増悪を認めなければデュルバルマブの維持療法(4週毎)に移行する ・16週(6サイクル目)にトレメリムマブを併用する (トレメリムマブは全5回投与) | 3週毎 |
| 非扁平上皮がんのみ シスプラチン75mg/m2、day1 もしくはカルボプラチンもしくは(AUC=5または6)、day1 ペメトレキセド*500mg/m2、day1 デュルバルマブ1500mg/body、day1 トレメリムマブ75mg/body、day1 ・4サイクル(12週間投与)終了後、増悪を認めなければデュルバルマブ+ペメトレキセドの維持療法(4週毎)に移行する ・16週(6サイクル目)にトレメリムマブを併用する (トレメリムマブは全5回投与) | 3週毎 | |
| 扁平上皮がんのみ シスプラチン75mg/m2、day1 もしくはカルボプラチンもしくは(AUC=5または6)、day1 ゲムシタビン1000または1250mg/m2、day1、8 デュルバルマブ1500mg/body、day1 トレメリムマブ75mg/body、day1 ・4サイクル(12週間投与)終了後、増悪を認めなければデュルバルマブの維持療法(4週毎)に移行する ・16週(6サイクル目)にトレメリムマブを併用する (トレメリムマブは全5回投与) | 3週毎 |
出典:日本肺癌学会.肺癌診療ガイドライン―悪性胸膜中皮腫・胸腺腫瘍含む―2023年版.II.非小細胞肺癌(NSCLC).Ⅳ期非小細胞肺癌レジメンより作成
免疫チェックポイント阻害薬レジメン
| ペムブロリズマブ単剤療法 | (PD-L1TPS1%以上のみ) ペムブロリズマブ200mg/body、day1 | 3週毎 |
| アテゾリズマブ単剤療法 | アテゾリズマブ単剤療法 (初回治療においては、PD-L1TC3/IC3のみ) アテゾリズマブ1200mg/body、day1 | 3週毎 |
| ニボルマブ+イピリムマブ療法 | ニボルマブ240mg/body、day1、15、29 イピリムマブ1mg/kg、day1 | 6週毎 |
| ニボルマブ単剤療法 | ニボルマブ240mg/body、day1 | 2週毎 |
出典:日本肺癌学会.肺癌診療ガイドライン―悪性胸膜中皮腫・胸腺腫瘍含む―2023年版.II.非小細胞肺癌(NSCLC).Ⅳ期非小細胞肺癌レジメンより作成
細胞傷害性抗がん薬+分子標的治療薬併用レジメン
| カルボプラチン+パクリタキセル+ベバシズマブ療法 | カルボプラチン(AUC=6)、day1 パクリタキセル200mg/m2、day1 ベバシズマブ15mg/kg、day1 ・パクリタキセル投与30分前までにデキサメタゾン、H1、H2blockerの前投薬を行う ・増悪しなければ上記を6サイクル以内で繰り返す ・プラチナ製剤併用療法の終了後、病勢増悪もしくは毒性中止までベバシズマブの単剤投与を継続する | 3週毎 |
| ドセタキセル+ラムシルマブ療法 | ドセタキセル60mg/m2、day1 ラムシルマブ10mg/kg、day1 | 3週毎 |
| シスプラチン+ゲムシタビン+ネシツムマブ療法 | シスプラチン75mg/m2、day1 ゲムシタビン1250mg/m2、day1、8 ネシツムマブ800mg/body、day1、8 ・4サイクル終了後、増悪を認めなければネシツムマブの単剤投与を継続する | 3週毎 |
出典:日本肺癌学会.肺癌診療ガイドライン―悪性胸膜中皮腫・胸腺腫瘍含む―2023年版.II.非小細胞肺癌(NSCLC).Ⅳ期非小細胞肺癌レジメンより作成
細胞傷害性抗がん薬(シスプラチンレジメン)
| シスプラチン+ペメトレキセド | シスプラチン75mg/m2、day1 ペメトレキセド*500mg/m2、day1 *4サイクル終了後、増悪を認めなければペメトレキセド単剤の維持療法を考慮する | 3週毎 |
| シスプラチン+ドセタキセル | シスプラチン80mg/m2、day1 ドセタキセル60mg/m2、day1 | 3週毎 |
| シスプラチン+ゲムシタビン | シスプラチン80mg/m2、day1 ゲムシタビン1000mg/m2、day1、8 | 3週毎 |
| シスプラチン+ビノレルビン | シスプラチン80mg/m2、day1 ビノレルビン25mg/m2、day1、8 | 3週毎 |
| シスプラチン+イリノテカン | シスプラチン80mg/m2、day1 イリノテカン60mg/m2、day1、8、15 | 4週毎 |
| シスプラチン+S-1 | シスプラチン60mg/m2、day8 S-140mg/m2、1日2回、day1-21 | 4~5週毎 |
出典:日本肺癌学会.肺癌診療ガイドライン―悪性胸膜中皮腫・胸腺腫瘍含む―2023年版.II.非小細胞肺癌(NSCLC).Ⅳ期非小細胞肺癌レジメンより作成
細胞傷害性抗がん薬(カルボプラチンレジメン)
| カルボプラチン+パクリタキセル療法 | パクリタキセル200mg/m2、day1 パクリタキセル投与30分前までにデキサメタゾン、H1、H2blockerの前投薬を行う | 3週毎 |
| カルボプラチン+ゲムシタビン療法 | カルボプラチン(AUC=5)、day1 ゲムシタビン1000mg/m2、day1、8 | 3週毎 |
| カルボプラチン+S-1療法 | カルボプラチン(AUC=5)、day1 S-140mg/m2、1日2回、day1-14 | 3週毎 |
| カルボプラチン+ナブ-パクリタキセル療法 | カルボプラチン(AUC=6)、day1 ナブ-パクリタキセル100mg/m2、day1、8、15 | 3週毎 |
| カルボプラチン+ペメトレキセド療法 | ペメトレキセド*500mg/m2、day1 *4サイクル終了後、増悪を認めなければペメトレキセド単剤の維持療法を考慮する | 3週毎 |
出典:日本肺癌学会.肺癌診療ガイドライン―悪性胸膜中皮腫・胸腺腫瘍含む―2023年版.II.非小細胞肺癌(NSCLC).Ⅳ期非小細胞肺癌レジメンより作成
細胞傷害性抗がん薬(ネタプラチンレジメン)
| ネタプラチン+ドセタキセル療法 | ネタプラチン100mg/m2、day1 ドセタキセル60mg/m2、day1 | 3週毎 |
出典:日本肺癌学会.肺癌診療ガイドライン―悪性胸膜中皮腫・胸腺腫瘍含む―2023年版.II.非小細胞肺癌(NSCLC).Ⅳ期非小細胞肺癌レジメンより作成
細胞傷害性抗がん薬単剤療法レジメン
| ドセタキセル単剤療法 | ドセタキセル60mg/m2、day1 | 3週毎 |
| ペメトレキセド単剤療法 | ペメトレキセド*500mg/m2、day1 | 3週毎 |
| S-1単剤療法 | S-180-120mg/body、1日2回、day1-28 | 6週毎 |
| ゲムシタビン単剤療法 | ゲムシタビン1000mg/m2、day1、8、15 | 4週毎 |
| ビノレルビン単剤療法 | ビノレルビン25mg/m2、day1、8 | 3週毎 |
| ナブパクリタキセル単剤療法 | ナブパクリタキセル100mg/m2、day1、8、15 | 3週毎 |
出典:日本肺癌学会.肺癌診療ガイドライン―悪性胸膜中皮腫・胸腺腫瘍含む―2023年版.II.非小細胞肺癌(NSCLC).Ⅳ期非小細胞肺癌レジメンより作成
肺がんの薬物療法の副作用
肺がんの化学療法で使われる薬には、殺細胞性抗がん剤(抗がん剤)、分子標的薬、免疫チェックポイント阻害薬の3タイプがあります。それぞれの薬は作用機序が異なるため、副作用も異なるものがあります。化学療法の副作用対策は、それぞれの症状に対してありますので、症状が出たり異変を感じたりした場合には、がまんせず医師や看護師に伝えることが大切です。薬の減量や休薬をすることなく計画通りに治療を行い、治療効果を得るためにも、副作用をうまくコントロールすることが大切です。
薬物療法(抗がん剤)の主な副作用
| 抗がん剤 | 分子標的薬 | 免疫チェックポイント阻害剤 |
| 悪心・嘔吐 | 下痢 | 疲労 |
| 食欲不振 | 皮疹 | かゆみ |
| 倦怠感 | 乾皮症 | 食欲低下 |
| 骨髄抑制 | 掻痒症 | 倦怠感 |
| 脱毛 | 爪囲炎 | 吐き気 |
| 口内炎 | 肝機能障害 | 下痢 |
| 下痢 | 悪心・嘔吐 | 間質性肺炎 |
| 腎障害 | 倦怠感 | |
| 末梢神経障害 | 間質性肺炎 | |
| 皮疹 | ||
| 間質性肺炎 |
悪心・嘔吐
悪心(吐き気)や嘔吐は、制吐剤といわれる吐き気を止める薬で予防が可能です。症状が長く続く場合は、水分や栄養の補給が必要になるため、医師、看護師、薬剤師に相談しましょう。
悪心・嘔吐は、副作用があらわれる時期で急性、遅発性、予期性の3つにわけられます。急性は、抗がん剤投与後の数時間以内に起こり、24時間以内に落ち着きます。遅発性は、24時間以降から、2~7日間続きます。予期性は、前回起こった副作用の経験から不安が生じることで起こるものです。
骨髄抑制
骨髄抑制は、骨髄という、血液細胞をつくる組織の働きが、抗がん剤の作用により抑制されることです。赤血球が抑制され減少すると貧血が、血小板が減少すると出血が起こりやすくなります。また、白血球(好中球)が減少すると感染症にかかりやすくなります。特に白血球の減少による感染症は重症になることもあるため、感染予防が大切です。
下痢
化学療法の副作用で起こる下痢には、早発性と遅発性の2つのタイプがあります。早発性は、治療当日に起こることが多く、副交感神経が刺激され腸の活動が活発になるために起こります。遅発性は、薬により腸粘膜がダメージを受けることで、治療後数日たってから起こります。下痢を繰り返すと脱水やミネラルバランスの異常を起こし、循環不全の原因になることもあります。整腸薬や止瀉薬などの薬で対処が行われます。
脱毛
殺細胞性抗がん剤の中には、がん細胞の特徴としても当てはまる「細胞分裂が活発な細胞」にダメージを与える薬があります。毛根も細胞分裂が活発なため、ダメージを受けて脱毛が起こります。脱毛は、頭髪だけではなく、眉毛、まつげなど全身の毛根に起こります。脱毛は、見た目が大きく変わるため、身体的なダメージよりもQOLへの影響が大きくなります。頭髪はカツラ(ウィッグ)や帽子などで、眉毛やまつげなどはメイクでカバーする方法があります。脱毛は、抗がん剤の開始後2~3週間で起こり始めますが、治療が終了すれば、3~6か月でまた毛が生え始めます。
間質性肺炎
間質性肺炎は、一般的な肺炎と異なり肺を形作る間質を中心に炎症が起こる病気です。肺がんの化学療法による副作用として起こる可能性があり、重症化すると命にも関わります。間質性肺炎は、肺の広い範囲で起こり、息切れや咳などの症状があらわれます。階段の上り下りやちょっとした運動でも息切れをする、乾いた咳が続く、発熱、などの症状があれば、すぐに医師や看護師に伝えましょう。
腎障害
化学療法により腎障害が起こることがあります。腎障害が起こると、さまざま副作用が起きやすくなるため、定期的に腎機能の検査を受け、早期に対応することが大切です。腎機能の低下により、抗がん剤を体外へ排出する機能の低下、尿量の減少、体重増加、むくみなどの症状があらわれます。
口内炎
化学療法による口内炎は、抗がん剤の直接的な作用と細菌感染が原因で起こります。症状は、口腔内の痛み、出血、刺激に対してしみる、乾燥する、赤くはれる、口が動かしにくい、飲み込みにくくなった、味が変わったなどさまざまです。一般的に抗がん剤投与を受けた後、数日から10日ころに発生しやすく、2~3週間で徐々に改善します。抗がん剤の多剤併用や種類、長期投与などの要因により重篤化することがあり、治療継続への影響もあるため、注意しながら治療が進められます。症状が悪化すると体力の低下や痛みはもちろん、不眠になったり、精神的な苦痛も大きくなったりするため、QOLへの影響も大きい副作用です。虫歯や歯肉炎があれば、抗がん剤投与前に治療しましょう。口腔内や唇の乾燥予防のために、リップクリームやうがいによる保湿、口腔内を清潔に保つための、口腔ケアが大切です。
皮膚障害
分子標的薬による皮膚障害には、手足症候群、皮疹、乾皮症、掻痒症、爪囲炎などがあります。いずれも致死的な副作用ではありませんが、見た目に関わる部位や、手足など日常生活に欠かすことができない部位に起こるため、QOLへの影響が大きい副作用です。皮疹には抗炎症治療、乾皮症には保湿剤による全身外用療法、爪囲炎にはステロイド外用薬や抗菌薬、テーピングや凍結療法などで対応されます。スキンケアと保清、保湿、保護を基本とした生活を心掛けることが大切です。
緩和ケア
緩和ケアは、患者さんががん治療中も自分らしく過ごすために、がんの治療に伴う身体的な痛みや心のつらさなどを和らげることです。緩和ケアは、がんが進行し治療法がなくなってから受けるものと誤解されることもありますが、正しくは、がんが見つかったときから治療中も必要に応じて行われるものです。
緩和ケア病棟や緩和ケアを専門にする病院では、緩和ケアに関しての専門的な知識と技術をもつ緩和ケアチームによるケアが受けられます。
入院治療中でも通院治療中でも緩和ケアは受けられます。手術による痛みはもちろん、化学療法によるつらい副作用の緩和、治療に対する不安や将来に対する不安など、さまざまなつらい症状を緩和するためのケアが受けられます。在宅療養中でも、在宅ホスピスや在宅緩和ケアを行う在宅医や訪問看護師による緩和ケアが受けられます。介護保険も申請すれば利用できるので、自宅で療養を続けることもできます。
参考文献:日本肺癌学会.肺癌診療ガイドライン―悪性胸膜中皮腫・胸腺腫瘍含む―2023年版.金原出版

