原発性骨髄線維症
原発性骨髄線維症とは
原発性骨髄線維症は、骨髄増殖性腫瘍のうち、骨の内側にある骨髄が線維化して固くなるものをいいます。同じく骨髄増殖性腫瘍の1つ慢性骨髄性白血病は、ほとんどが「フィラデルフィア染色体」の発生により発症します。一方で、原発性骨髄線維症ではフィラデルフィア染色体の発生は認められませんが、「JAK2遺伝子」の変化(変異ともいいます)が約50~60%、「MPL遺伝子」の変化が3~5%、「CALR遺伝子」の変化が20~30%の患者さんで認められています。
特発性造血障害に関する調査研究班が実施した日本血液学会認定施設へのアンケート調査によると、1999~2015年の17年間に782人が原発性骨髄繊維症と診断されました。米国の疫学調査では10万人あたり0.3人と報告されており、この発症率を日本の人口に単純に換算すると1年間に原発性骨髄繊維症と診断されるのは380人と推定されます。男女の比率は、2対1の割合で、発症年齢のピークは66歳です。
原発性骨髄線維症の症状
原発性骨髄線維症では、赤血球、白血球、血小板などの血液細胞が骨髄で正常に作られなくなり、さまざまな症状が起こります。基本的な病態は、骨髄の広範な線維化とそれに伴う髄外造血です。典型的な症状として、貧血症状、肝脾腫に伴う腹部症状があります。
約20%の患者さんでは、臨床症状がなく偶然の機会に発見されますが、約40%の患者さんでは、診断時に以下のような何らかの症状が認められます。
主な症状と頻度
・貧血症状
症状のうち最も多いのが動悸、息切れ、倦怠感などの貧血症状。診断時の患者さんのうち約20%に認められます。
・腹部症状
脾腫に伴う腹部膨満感、腹痛などの腹部症状が約10%の患者さんで認められます。
・出血症状
紫斑、歯肉出血などの出血傾向が約1%の患者さんで認められます。
・体重減少、発熱、盗汗(寝汗のこと)
これらの全身症状は、約10%の患者さんで認められます。
原発性骨髄繊維症の予後
原発性骨髄繊維症の予後分類には、「年齢」「症状(体重減少、寝汗、発熱など)」「ヘモグロビン値」「診断時の白血球数」「血中の芽球割合」の5つの因子による「IPASS分類」、IPASS分類の5つの因子に基づいて重みづけの調整をした「DIPASS分類」、DIPASS分類に「染色体異常」「血小板数」「輸血依存性」を追加した「DIPASS Plus」の3種類の国際分類が使用されています。 それぞれの因子をスコア化した合計により、低リスク、中間1リスク、中間2リスク、高リスクの4つのグループに分類されます。原発性骨髄線維症の血栓症リスク分類
<| 予後予測モデル | 予後不良因子(スコア) | 予後評価 | ||
|---|---|---|---|---|
| 合計 | リスク分類 | 50% 生存期間 | ||
| IPSS | 65歳以上:1点 発熱・夜間盗汗・体重減少の持続:1点 ヘモグロビン値10 g/dL未満:1点 白血球数2万5,000/μLを超える:1点 末梢血芽球1%以上:1点 | 0 | 低リスク | 11.3年 |
| 1 | 中間1リスク | 7.9年 | ||
| 2 | 中間2リスク | 4.0年 | ||
| 3以上 | 高リスク | 2.3年 | ||
| DIPSS/aaDIPSS | DIPASS 65歳以上:1点 発熱・夜間盗汗・体重減少の持続:1点 ヘモグロビン値10 g/dL未満:2点 白血球数2万5,000/μLを超える:1点 末梢血芽球1%以上:1点 | 0 | 低リスク | 未確認 |
| 1~2 | 中間1リスク | 14.2年 | ||
| 3~4 | 中間2リスク | 4.0年 | ||
| 5~6 | 高リスク | 1.5年 | ||
| aaDIPASS(65歳未満) 発熱・夜間盗汗・体重減少の持続:2点 ヘモグロビン値10 g/dL未満:2点 白血球数2万5,000/μLを超える:1点 末梢血芽球1%以上:2点 | 0 | 低リスク | 未確認 | |
| 1~2 | 中間1リスク | 9.8年 | ||
| 3~4 | 中間2リスク | 4.8年 | ||
| 5以上 | 高リスク | 2.3年 | ||
| DIPSS plus | 予後不良核型 [複雑核型(3種類以上の異常)、+8、-7/7q-、i(17q)、-5/5q-、12p-、inv(3)、11q23異常]:1点 血小板10万/μL未満:1点 輸血の必要性:1点 DIPSS 中間1リスク リスク:1点 DIPSS 中間2リスク:2点 DIPSS Highリスク:3点 | 0 | 低リスク | 15.4年 |
| 1 | 中間1リスク | 6.5年 | ||
| 2~3 | 中間2リスク | 2.9年 | ||
| 4~6 | 高リスク | 1.3年 | ||
出典:造血器腫瘍診療ガイドライン2023年版 第I章白血病 4.慢性骨髄性白血病/骨髄増殖性腫瘍 5.原発性骨髄線維症 表8より作成
原発性骨髄線維症の治療
WHO分類2017では、原発性骨髄線維症について、前線維化期と線維化期の2つに分けた診断基準が記載されています。
前線維化期原発性骨髄線維症に対する治療は、現時点では明らかなエビデンスがある治療はありませんが、原発性骨髄線維症の予後リスクに応じた治療方針に基づいた選択が推奨されています。血栓の既往がある患者さんに対しては、心血管リスクがある場合は血栓に対する予防治療が考慮されます。
線維化期原発性骨髄線維症から、骨髄線維症に進展した低リスクと中間-1リスクの患者さんでは、貧血症状や臨床症状がなければ生存期間は10年を超えるため経過観察が行われます。症状がある場合は、ルキソリチニブによる治療が行われます。ルキソリチニブは、血液系細胞の分化や増殖にかかわる酵素JAK1/2を阻害する分子標的薬です。骨髄線維症の主な症状のひとつである「腫れて大きくなっている脾臓」を縮小させ全身症状を改善する効果が期待できます。
中間-2リスクと高リスクの患者さんに対しては、治癒を目的とした同種造血幹細胞移植により、約50%の患者さんで長期生存が得られるという報告があり、推奨されています。同種造血幹細胞移植が適応とならない患者さんでは、ルキソリチニブによる治療が行われます。
貧血症状に対しては、赤血球輸血やタンパク同化ホルモンによる治療が行われます。
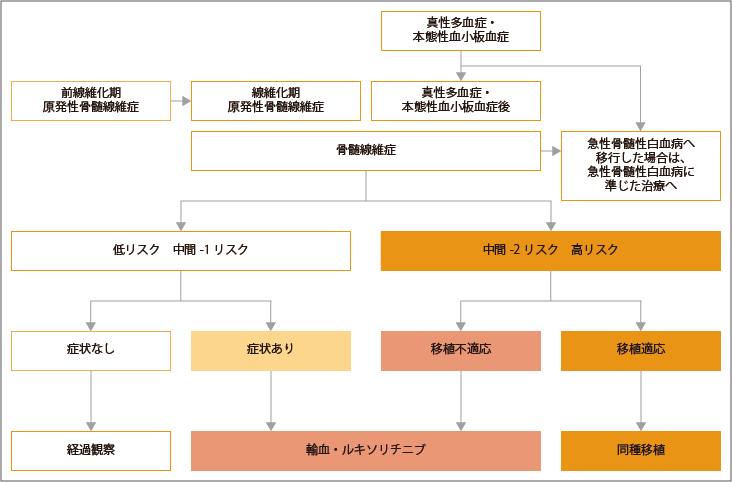 出典:一般社団法人日本血液学会編. 造血器腫瘍診療ガイドライン 2023年版.金原出版 第I章 白血病、4慢性骨髄性白血病/骨髄増殖性腫瘍、アルゴリズムより作成
出典:一般社団法人日本血液学会編. 造血器腫瘍診療ガイドライン 2023年版.金原出版 第I章 白血病、4慢性骨髄性白血病/骨髄増殖性腫瘍、アルゴリズムより作成参考文献:一般社団法人日本血液学会編. 造血器腫瘍診療ガイドライン 2023年版.金原出版 厚生労働科学研究費補助金 難治性疾患等政策研究事業 特発性造血障害に関する調査研究班 骨髄線維症診療の参照ガイド第6版 令和4年度改訂版

