再発
多発性骨髄腫の自家造血幹細胞移植、化学療法、救援療法、地固め・維持療法、支持療法など再発における治療法をご紹介します。
多発性骨髄腫の経過観察と効果判定検査
治療中は、定期的に必要な検査を受けることにより効果判定が行われつつ、経過観察が行われます。治療効果判定には、国際骨髄腫作業部会による統一効果判定基準が用いられます。効果判定では、Mタンパク量を調べる検査、測定可能な病変を調べる検査が行われます。
効果判定は以下の6つの基準で判定されます。
厳格な完全奏効(sCR)
完全奏効(CR)
最良部分奏効(VGPR)
部分奏効(PR)
安定(SD)
進行(PD)
効果判定は、1回の検査結果だけではなく、連続した検査を2回行った結果により決定されます。
完全奏効の効果判定には、血清中と尿中のMタンパク量、血清遊離軽鎖(FLC)の値の3つの測定可能病変のいずれかが当てはまる必要がありますが、「厳格な完全奏効」の場合のみ、この3つのどれにも該当していなくても判定されることがあります。
部分奏効または安定の効果判定では、新規治療開始後の1年間は月に1回、1年後からは2か月ごとの経過観察が行われ、測定可能病変がある患者さんには、「血清タンパク電気泳動法」と「24時間尿の尿タンパク電気泳動法」の2つの検査が行われます。
完全奏効判定を除き、血清タンパク電気泳動法のみでしか測定可能病変が判定できない患者さんには、血清タンパク電気泳動法のみが行われます。24時間尿の尿タンパク電気泳動法のみでしか測定可能病変が判定できない患者さんには24時間尿の尿タンパク電気泳動法のみが行われます。
血清タンパク電気泳動法または24時間尿の尿タンパク電気泳動法のどちらか1つ、もしくは2つの検査で測定可能病変が認められる患者さんは、Mタンパク測定値に基づいて効果判定が行われます。血清免疫グロブリン遊離軽鎖(FLC)検査法による効果判定は、血清タンパク電気泳動法や24時間尿の尿タンパク電気泳動法でMタンパク量の測定ができない患者さんに対して行われます。また、厳格な完全奏効の基準を満たしているかを判定する場合にも行われます。
完全奏効の判定では、必ず血清と尿について「免疫固定法」による検査が行われ、治療前のMタンパク量によらず血清と尿ともにMタンパクが陰性であることを確認します。治療前に24時間尿の尿タンパク電気泳動法が陰性であった患者さんでも完全奏効の確認のためには再度24時間尿の尿タンパク電気泳動法が行われます。
全身の骨の画像検査は、症状がない限り効果判定を目的には行われませんが、1年に1回受けることが推奨されます。
骨髄検査は、完全奏効の基準判定と非分泌型骨髄腫患者さんの効果判定のために行われます。
国際骨髄腫作業部会統一効果判定規準
| 効果 | 基準 |
|---|---|
| 厳格な完全奏効 (sCR) | 完全奏効規準を満たすとともに下記の条件を満たす FLC比が正常(0.26〜1.65)で、かつ免疫組織化学または免疫蛍光検査で骨髄中にクローン性細胞がみつからない |
| 完全奏効 (CR) | 血清と尿中のMタンパクがともに陰性化、かつ 軟部形質細胞腫が消失、かつ 骨髄中の形質細胞が5%未満まで減少 |
| 最良部分奏効 (VGPR) | 血清と尿中Mタンパクが免疫固定法では検出されるが、タンパク電気泳動では検出されない、または90%以上にMタンパクが減少し、かつ尿中Mタンパクも100mg/24時間未満まで減少 |
| 部分奏効 (PR) | 血清Mタンパクが50%以上減少し、かつ 24時間尿中Mタンパク量が90%以上減少するか 200mg/24時間未満まで減少 血清と尿中Mタンパクが測定可能病変でない場合には、Mタンパク規準の代わりに血清FLC値レベル間の差が50%以上の減少が必要 血清と尿中Mタンパクが測定不可能で、血清フリーライト検査も測定できない場合、治療前の骨髄形質細胞比率が30%以上なら、Mタンパク規準の代わりに形質細胞の50%以上の減少が必要 上記の規準に加えて、治療前に軟部形質細胞腫が存在した場合には測定可能病変の最長径と直交する短径の積和が50%以上減少していることも必要条件 |
| 安定(SD) | CR、VGPR、PR、PDのいずれの規準をも満たさない |
| 進行 (PD) | 下記の項目の1つあるいはそれ以上を満たす 最低値に比して下記の25%以上の増加 血清Mタンパク値(絶対値では0.5g/dL以上の増加) 尿中Mタンパク量(絶対値では200mg/24時間以上の増加) 血清と尿でMタンパク値が測定できない場合はFLCレベル間の差(絶対値では10mg/dL以上が必要) 骨髄形質細胞の割合(絶対値では10%以上が必要) 新規の骨病変出現または軟部形質細胞腫の出現、または既存の骨病変や軟部形質細胞腫の明らかな増大 高カルシウム血症の出現(補正血清Ca値≧11.5mg/dLで、純粋に骨髄腫に起因すると判断される場合) |
出典:一般社団法人日本血液学会編. 造血器腫瘍診療ガイドライン 2023年版.金原出版 第III章 骨髄腫、I 多発性骨髄腫 表6より作成成
それ以外の国際骨髄腫作業部会で用いられる効果判定基準
| 最小奏効 (MR) | 下記のすべての項目を満たす 血清Mタンパクの≧25%、<50%の減少、および24時間尿中Mタンパク量の≧50%、<90%の減少 軟部形質細胞腫の≧25%、<50%の縮小 溶骨病変の増大や数の増加を認めない |
| 免疫学的完全奏効 (iCR) | 厳格な完全奏効の規準を満たし、かつ5カラー以上のフローサイトメトリーを用いた少なくとも100万個の骨髄細胞の解析で表面形質上の異常な形質細胞を認めない |
| 分子学的完全奏効 (mCR) | 完全奏効の規準を満たし、かつ 感度10~5のASO-PCR法で骨髄中の形質細胞が検出できない |
出典:一般社団法人日本血液学会編. ”造血器腫瘍診療ガイドライン 2018年版”.金原出版、2018. 第III章 骨髄腫、I 多発性骨髄腫、「表7」をもとに作成
多発性骨髄腫の再発
再発や難治性となった場合、初回治療の最終日からの経過時間によって異なる治療が行われます。また、治療に用いる薬剤は、初回治療薬や患者さんの合併症、臓器障害などを考慮して選択されます。
自家造血幹細胞移植後に再発・難治性となった患者さんでは、初回治療終了時から18か月以上経過後に再発・再燃した場合は、初回治療と同じ「キーとなる薬剤」を使った寛解導入療法が行われます。また、初回治療とは異なる新たな救援療法と必要に応じて2回目の自家造血幹細胞移植または同種造血幹細胞移植が考慮されます。初回治療終了時から18か月未満で再発・再燃した場合は、キーとなる薬剤を変更した救援療法が行われます。
自家造血幹細胞移植非適応で奏効期間が9~12か月以上後に再発・難治性となった患者さんでは、初回治療が繰り返し行われます。奏効期間9~12か月未満だった場合は、初回治療と異なる薬剤による救援療法が行われます。
キーとなる「レナリドミド」「ボルテゾミブ」「レナリドミドとボルテゾミブ」「抗CD38抗体」による治療に抵抗性となった場合は、それぞれキーとなる薬剤を変更した救援療法が行われます。
キーとなる薬剤を変更した救援療法
| レナリドミド抵抗性 | |
| DBd療法 | ダラツムマブ+ボルテゾミブ+デキサメタゾン |
| PBd療法 | ポマリドミド+ボルテゾミブ+デキサメタゾン |
| PAN-Bd療法 | パノビノスタット+ボルテゾミブ+デキサメタゾン |
| Bd療法 | ボルテゾミブ+デキサメタゾン |
| Kd療法 | カルフィルゾミブ+デキサメタゾン |
| ボルテゾミブ抵抗性 | |
| DLd療法 | ダラツムマブ+レナリドミド+デキサメタゾン |
| ELd療法 | エロツズマブ+レナリドミド+デキサメタゾン |
| KLd療法 | カルフィルゾミブ+レナリドミド+デキサメタゾン |
| ILd療法 | イキサゾミブ+レナリドミド+デキサメタゾン |
| Ld療法 | レナリドミド+デキサメタゾン |
| Kd療法 | カルフィルゾミブ+デキサメタゾン |
| Td療法 | サリドマイド+デキサメタゾン |
| レナリドミドとボルテゾミブ抵抗性 | |
| DKd療法 | ダラツムマブ+カルフィルゾミブ+デキサメタゾン |
| DPd療法 | ダラツムマブ+ポマリドミド+デキサメタゾン |
| ISA-Kd療法 | イキサゾミブ+カルフィルゾミブ+デキサメタゾン |
| ISA-Pd療法 | イキサゾミブ+ポマリドミド+デキサメタゾン |
| EPd療法 | エロツズマブ+ポマリドミド+デキサメタゾン |
| Kd療法 | カルフィルゾミブ+デキサメタゾン |
| Pd療法 | ポマリドミド+デキサメタゾン |
| ISA±d療法 | イキサゾミブ±デキサメタゾン |
| CPd療法 | シクロホスファミド+ポマリドミド+デキサメタゾン |
| DXR-Bd療法 | ドキソルビシン+ボルテゾミブ+デキサメタゾン |
| 抗CD38抗体抵抗性 | |
| EPd療法 | エロツズマブ+ポマリドミド+デキサメタゾン |
| Kd療法 | カルフィルゾミブ+デキサメタゾン |
| Pd療法 | ポマリドミド+デキサメタゾン |
| CPd療法 | シクロホスファミド+ポマリドミド+デキサメタゾン |
| DXR-Bd療法 | ドキソルビシン+ボルテゾミブ+デキサメタゾン |
| DCEP療法 | デキサメタゾン+シクロホスファミド+エトポシド+シスプラチン |
| BDT-PACE療法 | デキサメタゾン+サリドマイド+シスプラチン+ドキソルビシン+シクロホスファミド+エトポシド±ボルテゾミブ |
赤文字:国内では保険適用外
既存の多発性骨髄腫に対する治療薬に抵抗性となった場合は、中枢神経病変がなく過去に同種造血幹細胞移植やBCMA CAR-T細胞療法を受けていなければ、CAR-T細胞療法が検討されます。
現在、国内の多発性骨髄腫に対するCAR-T細胞療法の適応条件は、免疫調節薬、プロテアソーム阻害薬、抗CD38モノクローナル抗体を含む3つの前治療歴があり、直近の前治療歴に対して病勢進行または治療後に再発・難治性の多発性骨髄腫とされています。
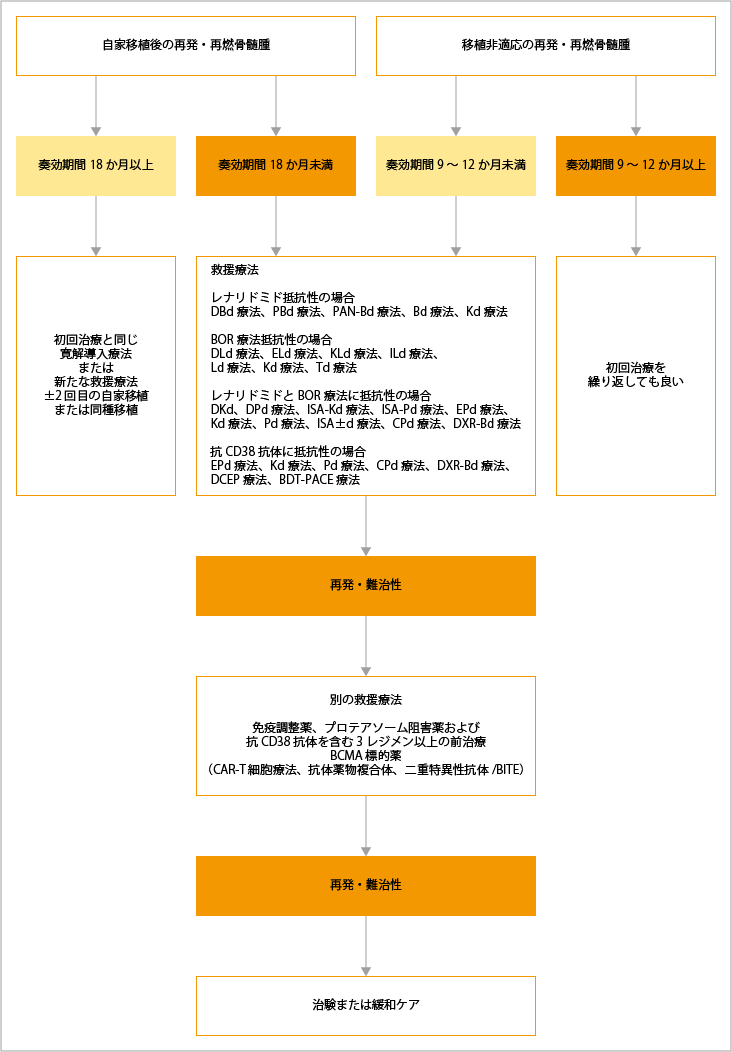
出典:一般社団法人日本血液学会編. 造血器腫瘍診療ガイドライン 2023年版.金原出版 第III章 骨髄腫、I 多発性骨髄腫 アルゴリズムより作成
参考文献:一般社団法人日本血液学会編. 造血器腫瘍診療ガイドライン 2023年版.金原出版

