胃がんの外科的手術はステージやがんの位置で選択 胃を残せるがんのタイプと残せる胃は残す手術とは

2018.2 取材・文:柄川昭彦
胃がんの治療に関する最新情報は、「胃がんを知る」をご参照ください。
胃がんの切除は、内視鏡的治療と開腹や腹腔鏡下による外科的手術による方法があります。外科的手術の対象となるのは、胃の近くにあるリンパ節への転移があるか、可能性がある胃がんで、遠隔転移はない場合というのが基本です。リンパ節への転移がなければ内視鏡的治療の対象となり、遠隔転移があれば化学療法や放射線治療の対象となります。胃がんの外科的手術は、胃切除とリンパ節郭清を組み合わせて行います。胃切除は切除する部分の違いにより、胃全摘、幽門側胃切除、幽門保存胃切除、噴門側胃切除、胃亜全摘といった種類があります。なるべく胃の全摘を避け、残せる胃を残すことで、術後の体重減少を防ぐことができます。術後の再発を防ぐため、必要に応じて術後補助化学療法を行います。最近は薬物療法の効果が高まったことから、ステージIVの胃がんでも、例外的に手術の対象となることがあります。
外科的手術の対象は粘膜に留まらず遠隔転移がない胃がん
胃がんは胃の粘膜から発生しますが、がんが粘膜に留まっている段階では、転移を起こしません。しかし、粘膜を越えて胃壁の深い部分へと広がっていくと、転移が起こるようになります。がん細胞がリンパ液によってリンパ節へと運ばれて増殖するためです。
血流による転移もあります。がん細胞が血液に乗って全身に流れ遠くの臓器で増殖するものです。胃がんなど消化器のがんでは多くの場合、最初は肝臓に転移します。このような遠く離れた臓器への転移を遠隔転移といいます。遠隔転移があると、ステージIVと診断されます。治癒を目指すのが難しい段階です。がんが胃壁を貫いて外に出て、こぼれ落ちたがん細胞が腹膜に転移することもあります。腹膜播種と呼ばれる転移で、これも遠隔転移の一種です。
外科的手術の対象となる胃がんは、「近くのリンパ節への転移があるか、あるいはその可能性があるもので、遠隔転移はないもの」というのが基本です。
胃の切除とリンパ節郭清を組み合わせた外科的手術
胃がんは切除が可能な段階で発見できれば、治癒を目指すことができます。外科的手術では、胃にあるがんを切除するのに加え、転移が起きているかもしれないリンパ節を取り除いて治癒を目指します。胃の切除とリンパ節郭清を組み合わせる外科的手術は、日本で開発されたものですが、現在では世界標準になっています。
胃の所属リンパ節には、胃の周りのリンパ節(1群リンパ節)、後腹膜のリンパ節・膵臓の周りのリンパ節・肝臓の周りのリンパ節(2群リンパ節)があります。1群のリンパ節を切除するのが「D1郭清」、それにいくつかのリンパ節を加えて切除するのが「D1+郭清」、1群と2群のリンパ節を切除するのが「D2郭清」です。
胃壁は内側から、粘膜、粘膜下層、筋層、漿膜下層、漿膜という5層構造になっています(図1)。粘膜で発生したがんが粘膜下層までに止まっているものを「早期胃がん」、それより深くまで達しているものを「進行胃がん」と呼びます。
内視鏡的治療の対象とならない早期の胃がんの場合、胃切除に加えて、D1郭清あるいはD1+郭清を行います。目に見えない微小ながんが広範囲に散らばっている可能性は低いので、胃に近いリンパ節だけを取り除きます。
進行胃がんの場合には、少し離れたリンパ節まで広がっている可能性があるので、胃切除に加えてD2郭清を行います。
図1:胃がんの深達度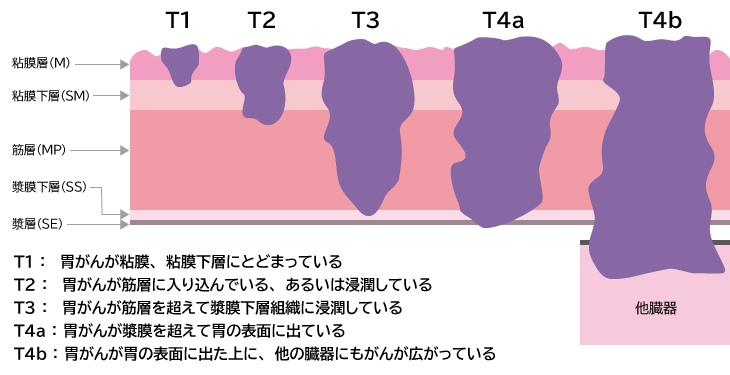
早期の胃がんなら機能を温存する切除術も可能
胃がんの外科的手術で行われる胃切除には、いくつかの方法があります。代表的なものが、次にあげる4つの切除術です(図2)。
- 胃全摘術
- 胃の全部を切除する手術で、胃の入り口にあたる噴門や、胃の出口にあたる幽門も失われます。がんが胃の中部や上部付近にできていて、噴門を残す余裕がない場合に行われます。
- 幽門側胃切除術
- 胃の出口に近い側を、2/3~4/5程度切除します。噴門は温存されますが、幽門は失われます。がんが幽門部付近や胃の下部にできている場合に行われます。胃がんの治療で最もよく行われる手術です。
- 幽門保存胃切除術
- 幽門側胃切除術において、幽門部を残して切除します。噴門部を含めた胃の上部と幽門部が残ることになります。がんが胃の下部にできていて、幽門を残してもがんから断端までの距離がしっかりとれる場合に行われます。
- 噴門側胃切除術
- 胃の入り口に近い側を、1/3~1/4程度切除します。がんが噴門部周辺や胃の上部にできている場合に行われます。日本では胃の上部にがんができることは少ないため、行われることは多くありません。
この4種類が代表的な切除術ですが、進行胃がんの場合には、基本的には幽門側胃切除術か胃全摘術が選択されます。早期胃がんであれば、がんのできている位置などにより、4種類の中から適切な切除術を選択することができます。
図2:胃切除術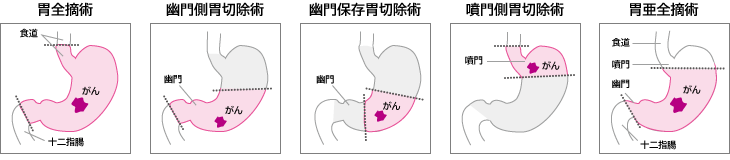
胃を残す手術は、食欲減退による体重減少を抑え術後補助化学療法への影響を少なくすること
胃がんの手術を受けると、十分な食事をとれなくなり、体重減少をきたすことがあります。食べたものをためておけないからだと考えられがちですが、それだけではありません。手術後に最も体重が減少するのは胃全摘術ですが、2番目は噴門側胃切除で、胃の3/4が残っていても、胃全摘術に次いで体重が減少してしまいます。逆に胃の上部を残せると体重減少が少なくてすみます。胃の上部をわずかに残し全体の5/6を切除する胃亜全摘術は、3/4が残る噴門測胃切除術より、術後に体重が減少しません。胃をどれだけ残すかが問題ではないのです。
術後に食事がとれなくなる最も重要な原因は、食欲低下や味覚障害にあります。胃の上部からはグレリンというホルモンが出ています。グレリンの90%はここから出ているため、胃の上部を切除すると、食欲が低下してしまいます。また、味を感じるレセプターの一種が、胃の入口と出口付近にあるといわれています。そのため、この部分が失われると、食べ物の味の感じ方が変わってしまいます。これも体重減少の原因になります。
こうしたことから、できるだけ胃全摘術を回避することが望ましいといえます。もちろん、胃がんを完治させることが最も重要ですから、胃全摘術が避けられない場合もあります。ただ、他の切除術が選択できるにもかかわらず、胃を全部取っておけば安心、といった考えで胃全摘術が行われるのは問題です。当院では、胃がんの手術のうち、胃全摘術の割合は約15%に過ぎません。早期胃がんに限ると、わずか1.9%でした。「残せる胃は残す」ことを大切にして、胃の上部をわずかに残す胃亜全摘術も行っています。
胃を残すことに力を注ぐのは、術後の体重減少が術後補助化学療法にも影響を及ぼしてしまうからです。補助化学療法を続けられるかどうかは、筋肉量に関係があり、筋肉量が減ると補助化学療法を続けられなくなることがあります。つまり、術後に食事ができるかどうかは、単にQOLだけの問題ではなく、予後に大きくかかわる問題でもあるのです。
適応が広がっていく腹腔鏡下手術
胃がんの外科的手術では、腹腔鏡下手術も行われています。腹壁を5~6か所小さく切開し、そこから腹腔鏡や手術器具を入れます。腹腔内に二酸化炭素のガスを入れて膨らませ、モニターに映し出された腹腔鏡の映像を見ながら手術を行います。手術の内容は、開腹手術の場合と同じです。
胃癌治療ガイドライン(第5版)では、日常診療で腹腔鏡下手術の対象となるのは、ステージIの幽門側胃切除術となっています。それ以外については、まだ臨床試験のデータがそろっていないためです。ただし、臨床試験では、進行胃がんに対する腹腔鏡下手術も行われるようになっています。将来的には、大きながんや他の臓器に浸潤しているようながんを除き、腹腔鏡下手術に変わっていくのではないかと考えられます。
腹腔鏡下手術には、開腹手術に比べて時間がかかる、高い技術水準が求められる、といった問題点はあります。しかし、出血量が少ない、手術後の痛みが軽い、手術後の回復が早い、傷跡が目立たない、腸の癒着が少ないといった数々のメリットがあります。患部を拡大して見ながら手術をするので、クオリティの高い手術が可能なのです。
術後は補助化学療法で再発を防ぐ
胃がんの外科的手術でがんのできている個所を切除しリンパ節郭清を行っても、再発が起きることがあります。画像検査などで見つけられない微小ながんがすでに全身のどこかに転移している場合、それが増殖することで手術の数か月後あるいは数年後にがんが現れてきます。これが再発です。
再発を防ぐために、ステージIIとIIIの進行胃がんに対しては、術後補助化学療法が行われています。術後に抗がん剤による治療を行い、どこかに潜んでいるかもしれない微小ながんを死滅させておくのです。
術後補助化学療法に使われるのは、S-1(製品名:ティーエスワン)という経口の抗がん剤で、1年間継続します。この治療を加えることで生存率が10%向上することが明らかになったため、現在の標準治療となっています(表1)。
ステージIIIで予後が悪いと考えられる場合には、より強力な術後補助化学療法として、カペシタビン(製品名:ゼローダ)+オキサリプラチン(製品名:エルプラット)の併用療法(XELOX療法)が選択されることもあります。この治療はS-1単独療法に比べて副作用が強いので、患者さんの状態を考慮して使う必要があります。
表1:胃がんの術後補助化学療法
| 使用薬剤: 一般名 (製品名) |
投与方法 | スケジュール | 代表的な副作用 | |
|---|---|---|---|---|
| S-1単独療法 | S-1(ティーエスワン) | 内服 | S-1を28日間毎日服用し、14日間休薬。6週間を1コースとし、1年間繰り返す | 食欲不振、口内炎、下痢、味覚障害、骨髄抑制 |
| XELOX (ゼロックス)療法 |
カペシタビン(ゼローダ)+オキサリプラチン(エルプラット) | 内服 +点滴静注 |
オキサリプラチンは1日目に点滴。カペシタビンは1日目から14日目まで毎日服用。7日間休薬。3週間を1コースとし、8回繰り返す | 手足症候群、末梢神経障害、吐き気、口内炎、疲労、骨髄抑制 |
術前補助化学療法でがんを小さくしてから手術する方法も
近年の胃がん治療は、薬物療法の進歩が目覚ましく、それに伴い、手術を組み合わせた新しい治療戦略がとられるようになっています。
胃がんが肝臓に転移するとステージIVであり、従来は手術の対象とはされていませんでした。しかし現在では、肝臓だけに3個以内の転移がある場合、通常の手術に加えて転移巣を切除する手術も行われるようになっています。術後補助化学療法を加えることで、30%程度の5年生存率が得られているためです。転移巣が1個の場合、5年生存率は50%程度になります。
また、胃から少し離れた部位に大きなリンパ節転移があるような場合には、手術前に抗がん剤治療を行い、がんを小さくしてから手術を行うこともあります。S-1+CDDP(一般名:シスプラチン)の併用による術前補助化学療法を行ってから手術することで、50%程度の5年生存率が得られています。
このように手術と薬物療法を組み合わせることで、従来は治癒が難しかった胃がんも治療の対象となっています。今後、新しい薬剤と手術を組み合わせた臨床試験が進むことで、胃がんの手術療法の治療成績は、さらに向上していくと考えられます。
プロフィール
比企直樹(ひき・なおき)
1992年 Research Fellowship in General Surgery, University of Ulm(Germany)
1993年 東京大学医学部附属病院分院第三外科学教室助手、青梅市立総合病院外科
1995年 Research & Clinical Fellowship in General Surgery, University of Ulm(Germany)
1998年 東京大学大学院医学系研究科博士課程卒業、東京大学附属病院分院第三外科助手
2001年 東京大学医学部附属病院胃食道外科助手
2005年 癌研究会有明病院消化器外科医員
2007年 癌研究会有明病院消化器外科医長
2012年 癌研究会有明病院栄養部部長
2013年 癌研究会有明病院消化器外科胃外科部長

