大腸がんの個別化医療 内視鏡検査と診断・治療、初期治療後の経過観察

2018.8 取材・文:池内加寿子
大腸がんの治療に関する最新情報は、「大腸がんを知る」をご参照ください。
わが国は、工学技術も専門医の医療技術も、消化器内視鏡領域では世界の最先進国といっても言い過ぎではありません。実際、世界中で使われている内視鏡の9割以上が日本製です。大腸がんの診断治療では、内視鏡は、がんの診断にとどまらず、がんの進行具合の評価や早期がんの切除、さらには良性のポリープのなかでもいずれがんになる可能性のある前がん病変(腺腫)を発見・切除し、がんを未然に防ぐ役割も担っています。
大腸内視鏡検査の対象者は
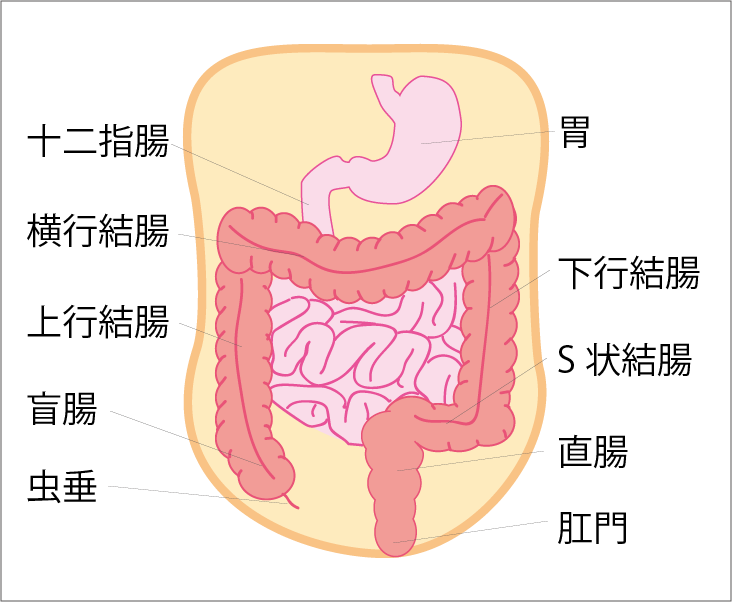
大腸は、口から始まる消化管の最後の部分にあたる臓器です。長さは1.5~2mで、右下腹部下にある小腸の出口(盲腸)から上に向かう上行結腸、横方向に続く横行結腸、下に向かう下行結腸、便を貯めるS状結腸、直腸と、腹部を大きく円を描いて回り、肛門へと続きます(図1参照)。
大腸がんは、大腸の管の一番内側の粘膜から発生します。人間の体を「ちくわ」にたとえれば、大腸は内側の穴にあたり、粘膜はその表面にあたります。そのため、穴の内側を見ることができる内視鏡を用いれば、症状が出ないうちに病変を発見し、削り取ることが可能です。
図1 大腸の各部位
現在、国の施策により、大腸がんの死亡率を減らすための大腸がん検診として、便潜血検査が多くの自治体の成人健診などで行われています。便をスティックでなぞって保存液の入った容器に戻すだけの簡単な検査で、通常2日間分を採取します。この便潜血検査で血液が検出され、陽性(要精密検査)とされた人には、精密検査として主に大腸内視鏡検査が勧められています。
大腸内視鏡検査で、がんの疑いが確認できれば、内視鏡で組織を採取してがんかどうかの確定診断を行います。その後、病変の大きさ、深達度、組織の性質のほか、リンパ節転移や遠隔転移の有無などをさまざまな検査で調べ、ステージ分類と治療方針が決定されます。
全身にX線を当て、体を輪切りにしたような画像を撮影しコンピューターで再現する検査がCTです。CTでは、一般的に造影剤が使われ、肝臓や肺、リンパ節への転移の有無や程度を調べたり、どこまで浸潤しているかなどを調べるために行います。
便潜血検査では初期の大腸がんが陽性にならない場合があると指摘する意見もあります。そのため、便潜血検査によるスクリーニング検査は行わずに、大腸内視鏡検査を行うほうが有益なのかどうかについては現在、調査研究が行われている段階です。
大腸がんは中高年以降に増えるので、年齢が50歳以上の人や、ご家族に大腸がんが多い人も、念のために大腸内視鏡検査を受けておくとよいでしょう。
大腸内視鏡の最新機能と検査
大腸内視鏡は、大腸内部をリアルタイムに観察できる医療機器です。カメラを内蔵した細長い管を肛門から挿入すると、大腸内壁の様子が鮮明なカラー動画でモニターに映し出されます。大腸内視鏡の操作によって、良性のポリープや腺腫、大腸がんなどを発見し、それらの病変を詳細に観察することができます。
大腸内視鏡には、カメラのほかにもいろいろな機能が付属しています(図2参照)。大腸内に空気や水を送り込んだり、病変部の変化をよりわかりやすくするために着色用の色素をまいたりすることもあります。管の先端から、鉗子やスネア(リング状の切除用機器)、電気メスなどを出して組織を採取したり、ポリープを切除することもできます。これらの機能によって、ポリープや大腸がんの画像検査、組織採取、診断、ポリープや粘膜内がん(早期がん)などの切除(内視鏡的切除)が可能です。
図2 大腸内視鏡の先端部

カメラレンズや照明とともに、送水や吸引、処置具を出し入れする孔などがある
写真提供:オリンパス株式会社
大腸の内視鏡検査を受けるときには、患者さんは前もって下剤を飲み、大腸の中を空にします。大腸内に便が残っていると画像が見にくく、病変を見逃す恐れがあるからです。
内視鏡医は、大腸内視鏡を肛門から挿入し、直腸→S状結腸→下行結腸→横行結腸→上行結腸→盲腸と大腸内を便の進行とは逆の方向に、小腸の最後の部分まで進めます。奥から大腸内視鏡を戻していくときには、大腸の中を空気や二酸化炭素で膨らませながら、病変の有無や大きさなどを細かく観察していきます。
大腸内視鏡検査で痛みを感じる場合がありますが、近年では、大腸内視鏡の管も11~12mm程度と細く、また軟らかくなっています。熟練した内視鏡医が増えてきたこともあって、10年前に比べると患者さんの負担は非常に軽くなっています。検査を受けるときに着る検査着は、下半身が露出しないよう工夫されています。患者さんの希望により、鎮静剤を使い、寝ている間に楽に検査を受けられる医療機関もありますから、痛みなどが心配な人は担当医に相談してみてください。
大腸内視鏡でできること
大腸内視鏡検査は通常、がんの早期発見、早期治療を目標にしていますが、大腸に関してはそれらに加えて、放置するとがんになる可能性のある前がん病変のポリープ(腺腫)の発見・診断・治療を行い、大腸がんを未然に防ぐことも重要な役割です。大腸がんにおける内視鏡の主な役割は、ポリープや早期がんなどの病変の発見、深達度、ステージ(病期)の診断、治療(切除)と、幅広いです。
大腸がんには、発生時から悪性のものと、腺腫と呼ばれる前がん病変のポリープ(良性腫瘍)ががん化したものがあり、後者が大半といわれています。そのため、ポリープを含めた病変を発見することがとても重要です。
ポリープや大腸がんなどの病変を見つけたら、まず、空気を入れたり色素を使ったりしながら、大きさ、形、位置、硬さなどを観察し、深達度を調べます。
大腸の壁は、厚さが4mmほどあり、内側から、粘膜、粘膜下層、固有筋層、漿膜下層、漿膜という5層構造になっています(図3)。
大腸がんの場合は、進行するとともに、粘膜→粘膜下層→固有筋層へと大腸の壁の中に深く浸潤(侵入)していきます。そのため、大腸がんが疑われる場合は、がんが粘膜内にとどまっているのか、粘膜下層まで浸潤しているか、それより深いかなど、深達度(深さ)の見極めが非常に重要です。深達度が、病期診断や治療方針の決定に欠かせないからです。
図3 壁深達度
| TX | 壁深達度の評価ができない |
| T0 | がんを認めない |
| Tis | がんが粘膜内にとどまり、粘膜下層に及んでいない |
| T1 | がんが粘膜下層までにとどまり、固有筋層に及んでいない |
| T1a | がんが粘膜下層までにとどまり、浸潤距離が1000um未満 |
| T1b | がんが粘膜下層までにとどまり、浸潤距離が1000um以上 |
| T2 | がんが固有筋層まで浸潤し、これを超えていない |
| T3 | がんが固有筋層を超えて浸潤している |
| T4 | がんが漿膜表面に接しているか、または露出、あるいは直接多臓器に浸潤している |
| T4a | がんが漿膜表面に接しているか、またはこれを破って腹腔に露出している |
| T4b | がんが直接多臓器に浸潤している |
Tis

T1a

T1b

T2
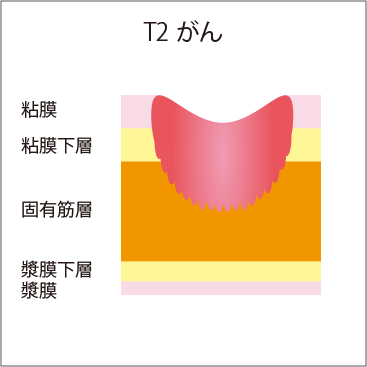
T3
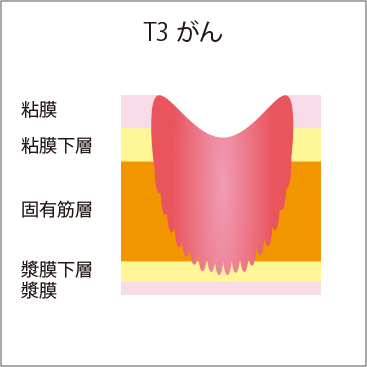
T4a
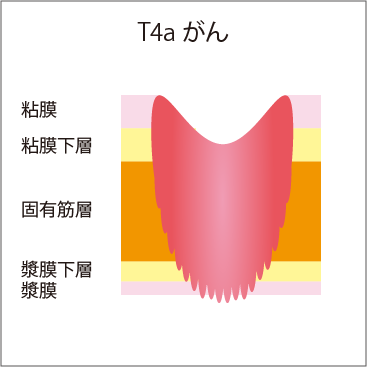
T4b

深達度もほぼ推測できる
最近では、80~100倍程度に拡大して見られる拡大内視鏡という解像度の高いハイビジョンの内視鏡や、特殊な光を放つ内視鏡も普及しています。これらの高性能の内視鏡では、ポリープや大腸がんなどの表面の模様や微小血管を詳細に観察できます。病変の粘膜表面の模様は一般的にピットパターンと呼ばれています。
大腸がんの浸潤が進むほど、ピットパターンが乱れてきます。腸管の粘膜には、粘液を出したり水分を吸収したりするための腺管という管が粘膜表面に開いており、ピットとはその開口部の穴のとこです。正常の大腸粘膜では、丸いピットが均一に並んでいます。一方、主要部では、丸い形が細長くなったり、いびつになり、さらにがんが深く浸潤すると、つぶれてなくなったりします(図4参照)。拡大内視鏡でピットパターンを観察することによって、深達度をほぼ推測することができます。
これらの観察によって、放置してもよいポリープなのか、放置するとがんになる可能性のある良性の腺腫なのか、早期がんなのか、がんが粘膜からどの程度深く入り込んでいるのか(深達度)、などを見分けています。
このほか、超音波内視鏡という機器もあり、これは内視鏡の先端から超音波を発してその反響を利用して、大腸の壁の深い層を観察するものです。粘膜下腫瘍という、深い筋肉の層から発生する腫瘍は、粘膜表面からは観察できないので、超音波内視鏡を使うこともあります。また、大腸粘膜から深く浸潤した大腸がんの深達度をより詳細に調べるときに使われることもあります。
図4 ピットパターン
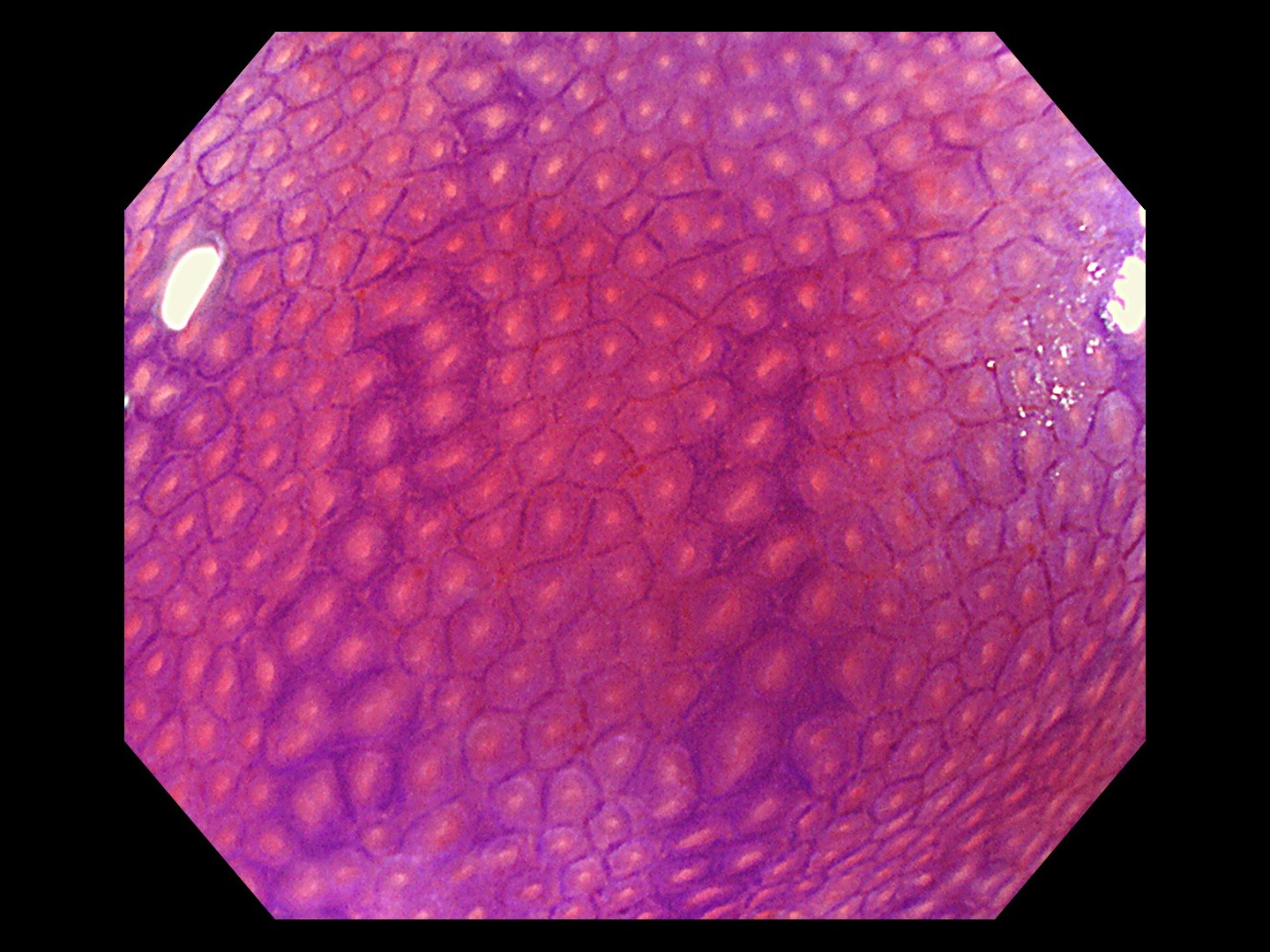
正常
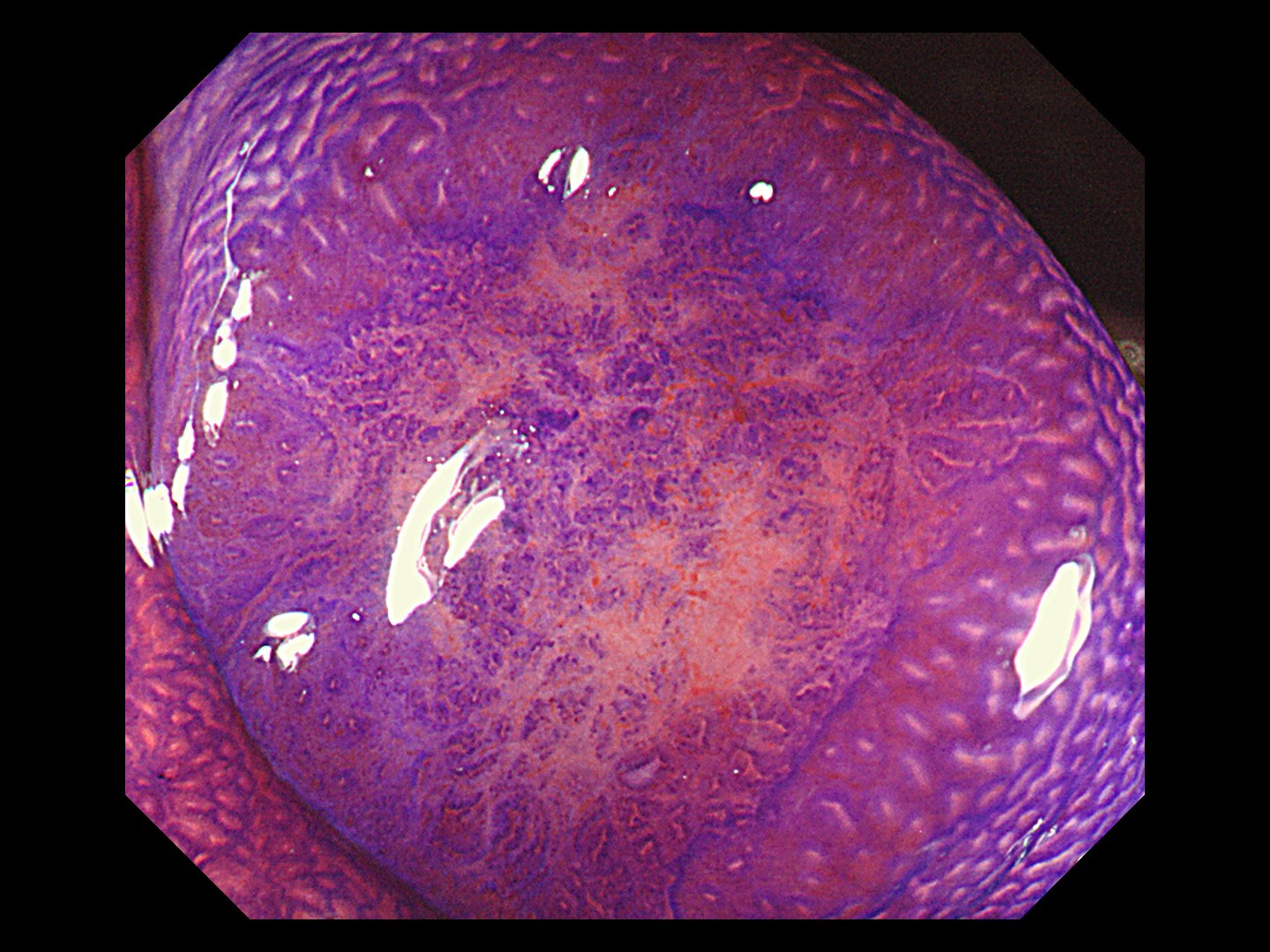
がんが粘膜下層に達したもの。ピットパターンが崩れている
組織型、分化度などを調べ、ステージ分類
なお、ポリープかがんか迷う場合や、明らかに進行がんの場合は、組織生検を行います。内視鏡でがんの組織の一部を1~2mm程度、1~数か所ほど採取し、病理検査を行います。その結果に応じて、がんの進行度に合わせた治療方針をたてます。
病理検査では、大腸がんの組織型、グループ分類(グループ1:正常組織、2:腫瘍か非腫瘍か不鮮明、3:良性腫瘍、4:悪性腫瘍または良性腫瘍か不鮮明、5:がん)、分化度(未分化がん、高分化型、中分化型、低分化型など)などを調べます。この結果も、治療方針の決定の際に重要な要素となります。
深達度が粘膜下層1mm未満のT1aまでは内視鏡的切除
大腸がんが粘膜にとどまっている粘膜内がん(Tis)はステージ0に分類され、リンパ節転移の可能性がないので、内視鏡で切除し、完全に取り切れれば完治します(図5参照)。
大腸がんが粘膜下層に浸潤している場合(T1:ステージI)は、粘膜下層から1mm未満の深さ(T1軽度浸潤:T1a)であれば、リンパ節転移の可能性はほとんどないので、内視鏡的切除の対象になります。内視鏡で切除をすればほぼ完治し、外科的切除(開腹手術または腹腔鏡下手術)の成績と遜色はありません。
一方、粘膜下層に1mm以上の深さまで浸潤している場合(T1高度浸潤:T1b)は、リンパ管や血管を通して、リンパ節転移を起す可能性が数%出てきます。そのため、大腸癌治療ガイドラインでは、T1bは外科的切除の適応としています。ただ、高齢者などで、手術を避けたいという希望がある場合などは、ケースバイケースで内視鏡的切除を検討することもあります。
図5 T1aまでの大腸がんの治療選択
| 0期 | I期(T1b/T2) | IV期 | ||||
| I期(T1a) | II期 | ↓ | ↓ | ↓ | ||
| ↓ | III期 | ↓ | ↓ | ↓ | ||
| ↓ | ↓ | ↓ | ↓ | ↓ | ||
| 内視鏡治療 | → | 手術(外科治療) ・開腹手術 ・腹腔鏡下手術 (+リンパ節郭清) | ↓ | ↓ | ||
| ↓ | ↓ | ↓ | ↓ | |||
| 経過観察 | ← | 手術後 病理検査・病理診断による検討 | ↓ | ↓ | ||
| ↓ | ↓ | ↓ | ||||
| 薬物療法 放射線治療 | ↓ | |||||
| ↓ | ↓ | |||||
| 対処療法 | ||||||
早期大腸がんとポリープ(前がん病変)の治療
高度に進んだ大腸内視鏡の性能、診断技術は、大腸の病変がどのようなタイプかに応じた、より個別的な治療を可能にしています。
「過形成性ポリープ」と呼ばれる良性のポリープは、以前はがん化しないと考えられていましたが、高性能の大腸内視鏡の登場によって、過形成性ポリープと似た病変の中にも「鋸歯状腺腫」という、がんのリスクを伴う病変を特定できるようになりました。「鋸歯状腺腫」の中でも、大腸の右側にあり、形が平らで10mmを超えて大きくなってくるものは、通常の腺腫より悪性化しやすく予後も悪い可能性があると報告されています。その治療をどのようにするかなどを含め、今後の研究に注目が集まっています。
検査時に前がん病変を一括切除
大腸内視鏡で前がん病変の腺腫を発見・切除することにより、大腸がんの死亡率を7割程度減らせると報告されています(米国の研究)。内視鏡によって、大腸がんを早期に発見することはもちろん、大腸がんになる前の段階で切除し、がん化を未然に防ぐ治療も行われます。
大腸内視鏡検査で、腺腫(前がん病変の良性ポリープ)が発見された場合、その場で切除するかどうかは、各医療機関の方針によって異なります。10mm程度までのポリープは外来でも比較的安全に切除することができます。
内視鏡的切除の方法
ポリープや大腸がんが、深達度Tis、T1aで内視鏡的切除の適応であれば、ホットバイオプシー(hot biopsy)、ポリペクトミー(Polypectomy)、内視鏡的粘膜切除術 (EMR: endoscopic mucosal resection)、内視鏡的粘膜下層剥離術(ESD: endoscopic submucosal dissection)などの方法で、切除治療を行います。
●ホットバイオプシー
2~3mm程度の小さなポリープなどを、クリップ状の鉗子でつかみ、熱凝固で切り取る方法です。
●ポリペクトミー
キノコのような茎のある、1cm前後の比較的小さな隆起性ポリープに、大腸内視鏡の先端から出したスネアと呼ばれる金属の輪をかけて引き絞り、通電して切除する治療法です。通電せずに、ちぎり取る場合もあります。
●EMR(内視鏡的粘膜切除術)
2cm程度までの腺腫や早期の大腸がんにスネアをかけて切除する方法です。茎がない場合やスネアが引っかかりにくい場合は、粘膜下層に生理食塩水を注入して、病変部を持ち上げてから行います。
●ESD(内視鏡的粘膜下層剥離術)
早期がんが、平たく大きい場合などは、スネアのかかりが悪いことがあります。そのような場合は、内視鏡付属の電気メスで、粘膜下層から病変を少しずつ切り離して剥離するESDという方法が用いられます。この場合、粘膜下層にヒアルロン酸などを注入して、病変部を持ち上げて行います。ヒアルロン酸は、生理食塩水より保水力が高く、長い時間保持できます。
ESDはEMRより時間がかかり、難易度が高いので、熟練した専門医が行うことが望まれます。
内視鏡的切除後は、切除組織を病理検査に出し、水平断端、垂直断端ともに陰性で、転移を来す要素がないことが確認できれば、治療は終了です。
治療後の経過観察と内視鏡検査
1回目の内視鏡検査で、腺腫(前がん病変のポリープ)の見つかる個数が多い人は、今後もポリープができやすく、大腸がんにもなりやすいと考えられますから、3年以内に大腸内視鏡検査を受けるとよいでしょう。ポリープの治療後の対応に関するガイドラインは現在作成中で、まだ明確な方針は決められていませんが、病変の数や大きさ、組織型等に応じた大腸内視鏡の検査間隔が提示される可能性があります。
大腸がんの治療後は、再発の可能性が高い5年間は、フォローアップのための他の検査とともに、定期的に大腸内視鏡検査を受けることが大切です。
早期大腸がんをEMRやESDなどの内視鏡的切除で治療して、治癒切除された(がんが取り切れている)人は、1年以内に大腸内視鏡検査を受けます。
治療後の病理検査の結果、転移する可能性が完全には否定できないと判断された場合、大腸内視鏡検査を受けるとともに、造影CT検査などでリンパ節転移や遠隔転移がないかを調べ、慎重に様子を見ます。
なお、垂直方向の断端が陽性の場合は、深く浸潤していたり、リンパ節転移を起している可能性も出てくるので、追加切除が推奨されています。
進行大腸がんの治療選択と遺伝子検査
固有筋層より深く浸潤している場合(T2、T3、T4a、T4b:ステージII)は、分類上は進行がんと呼ばれています。深く浸潤するほどリンパ節転移の可能性が高くなるので、内視鏡的切除の適応からは外れ、外科的切除の対象になります。リンパ節転移(N1a~N3)がある場合(ステージIII)も同様です。
肺転移、肝転移などの遠隔転移(M1a~M1c)がある場合(ステージIV)、多くのがんでは手術適応外となるのに対して、大腸がんでは、条件によって外科手術で転移巣を切除することにより長期生存を目指せるケースもあります。切除不能の場合は、化学療法が検討されます。
RAS遺伝子変異
内視鏡検査で非常に進行したステージIVの大腸がんが発見されることがまれにあります。外科的切除の適応にならず、化学療法だけで治療することになった場合、薬剤の選択のために、内視鏡で採取した組織に対して遺伝子検査を行い、遺伝子の異常の有無を調べることがあります。
切除不能進行再発大腸がんに使われる分子標的薬の抗EGFR抗体薬セツキシマブ(製品名:アービタックス)、パニツムマブ(製品名:ベクティビックス)などは、遺伝子変異の1つであるRAS(ラス)遺伝子(K-RAS/N-RAS)変異がある患者さんには効果が期待できません。そのため、RAS遺伝子の検査で変異が認められた患者さんには、抗EGFR抗体薬以外の薬剤を選択することになります。検査を受けた人の約半数に、RAS遺伝子変異が認められるといわれています。
BRAF遺伝子変異
大腸がんに関連する遺伝子検査としては、新たに2018年8月から、BRAF(ビーラフ)遺伝子変異の検査が健康保険で受けられるようになりました。
BRAF遺伝子の変異は、大腸がんの5~15%にみられ、前述の鋸歯状腺腫がある人に多く認められる予後不良因子です。鋸歯状腺腫が進行がんに進展し、化学療法が予定されている場合などで、BRAF遺伝子変異があった人は、通常より強い治療を検討します。大腸がんの化学療法で通常用いる5FU、オキサリプラチン(製品名:エルプラット)、イリノテカン(製品名:カンプト/トポテシン)に分子標的薬のベバシズマブ(製品名:アバスチン)を加えたレジメン(FOLFOXILI+BV療法)などが選択肢になります。
このように、手術不能の大腸がんでも、内視鏡で採取したがんの組織を用いた遺伝子検査による個別化医療が進んでいます。
AI(人工知能)と内視鏡読影
最近では世界各国で、人工知能(AI)の技術が進み、日本でも一部の医療機関で内視鏡治療に応用されています。当院でも開発研究として、内視鏡の臨床画像をAIに多数記憶させ、大腸がんか腺腫性のポリープかそれ以外のポリープかを鑑別させるソフトを作成し、内視鏡検査に導入しています。
内視鏡検査中の画像は常に動いているので、一瞬ポリープが現れても、ほかの場所に意識を集中していると見損なうことがあり、医師の技量や経験により検出の度合いに差が出ることがあります。その点、AIではチェックが均一で、検出の確率が高くなることが考えられます。
AIは膨大なデータを限界なく記憶して管理できるので、将来的にはポリープやがんの発見が容易になり、見落としも減り、病気の鑑別や深達度等の診断の精度も高まる可能性があります。医師の心強いサポート役として将来の展開に大きな期待が寄せられています。
プロフィール
炭山和毅(すみやま かずき)
2000年 東京慈恵会医科大学大学院医学研究科博士課程卒業。学位受領。東京慈恵会医科大学内視鏡科助手。東京慈恵会医科大学附属病院内視鏡部診療医員
2005年 米国Mayo Clinic College of Medicineに博士研究員として留学
2007年 東京慈恵会医科大学附属青戸病院内視鏡部診療医員
2009年 東京慈恵会医科大学附属病院内視鏡部診療医員
2012年 東京慈恵会医科大学内視鏡科講師
2013年 東京慈恵会医科大学附属病院内視鏡部診療医長
2015年 東京慈恵会医科大学内視鏡科教授。東京慈恵会医科大学附属病院内視鏡部診療部長
2016年 東京慈恵会医科大学大学院医学研究科消化器内視鏡診療治療学教授

